Relations interspécifiques entre le natif Pissodes validirostris et l’invasif Leptoglossus occidentalis : quelles conséquences ?
Vincent Lesieur
61, avenue des Cévennes
34980 Saint Gély du Fesc
vincent.lesieur45 (at) gmail.com
(Version PDF)
Résumé
Leptoglossus occidentalis, la punaise prédatrice des graines de conifères, native de l’Ouest américain, a été accidentellement introduite en Europe. Ce ravageur se nourrit des graines et provoque de sérieuses réductions de production en vergers à graines mais aussi en peuplements naturels. Dans le contexte des ravageurs des graines ou des cônes, un partage de la ressource peut entrainer une diminution drastique de la production de graines, les dégâts des espèces introduites pouvant s’ajouter à ceux des espèces indigènes. Néanmoins, les connaissances sur les relations de L. occidentalis avec les autres espèces partageant la même ressource, comme le charançon Pissodes validirostris (natif d’Europe), sont très limitées. La caractérisation des relations de cette espèce avec la faune déjà présente permettra d’une part, d’identifier l’impact potentiel de ce ravageur sur la faune native et d’autre part, d’évaluer le risque pour la régénération naturelle des peuplements de conifères (e.g. dégâts additifs). A travers une expérience menée en conditions semi-contrôlées dans un peuplement de pins sylvestres des Hautes-Alpes et un suivi des populations dans ce même peuplement, les relations entre ces deux espèces ont été étudiées. En conditions contrôlées, les deux espèces semblent avoir un impact négatif l’une sur l’autre. En conditions naturelles, les deux espèces semblent cohabiter à la fois dans le même peuplement mais aussi sur le même arbre. Cette observation indique donc que les dégâts dus à L. occidentalis s’ajoutent à ceux du charançon. L’action combinée de ces deux ravageurs pourrait donc potentiellement constituer un sérieux problème pour la régénération naturelle de certains peuplements. Cette étude apporte les premiers éléments de discussion sur les nouvelles interactions interspécifiques créées depuis l’arrivée de L. occidentalis en Europe. Ces résultats apportent également de nouvelles informations sur l’impact écologique des invasions biologiques (i.e. nouvelles interactions interspécifiques, impact potentiel sur la régénération), ce domaine ayant parfois été négligé aux dépens de la quantification de l’impact économique.
Justification
Les invasions biologiques sont souvent considérées comme la deuxième cause mondiale de perte de biodiversité après la destruction des habitats (Vitousek et al. 1997). En effet, les espèces invasives peuvent perturber le fonctionnement des écosystèmes et affecter les espèces indigènes de manière indirecte (e.g. effets cascade (Gandhi & Herms 2010)) ou directe (e.g. prédation, compétition pour la ressource (Kenis & Branco 2010)). Dans ce contexte, de nouvelles interactions interspécifiques se créent, les niches écologiques investies par les espèces exotiques étant dans la majorité des cas déjà occupées. Ces nouvelles interactions peuvent alors entrainer soit un déplacement écologique (i.e. déplacement ou réduction de la niche écologique d’une ou plusieurs espèces permettant ainsi la coexistence), soit dans des cas de compétition drastique, l’exclusion de l’une des espèces. Par exemple, chez les insectes et les arachnides, une espèce exotique provoquait le déplacement compétitif d’une espèce native dans 33% des cas et d’une autre espèce exotique déjà établie dans 55% des cas (Reitz & Trumble 2002).
Leptoglossus occidentalis, la punaise prédatrice des graines de conifères, native de l’Ouest américain, a été accidentellement introduite en Europe à la fin des années 90. Depuis les premières observations en Italie, ce ravageur des graines de conifères a été observé sur une grande partie du territoire européen (Fent & Kment 2011). Cette espèce polyphage, se nourrissant des graines, provoque de sérieuses réductions de production en vergers à graines mais aussi en peuplements naturels, comme observé dans des peuplements alpins de pins (Lesieur et al. 2014). Ces diminutions de productions peuvent avoir un impact écologique non négligeable puisque limitant le potentiel de régénération naturelle.
Dans le contexte des ravageurs des graines ou des cônes, un partage de la ressource peut entrainer une diminution drastique de la production de graines, les dégâts des espèces introduites pouvant s’ajouter à ceux des espèces indigènes (Auger-Rozenberg & Roques 2012). Les connaissances sur les relations de L. occidentalis avec les autres espèces partageant la même ressource sont très limitées dans la zone d’origine de cet insecte et totalement inconnues dans la zone européenne envahie.
Chez les Pinaceae, la production de cônes est très variable dans l’espace mais aussi dans le temps. Tous les trois à cinq ans, on peut observer de « bonnes années » où des dizaines de cônes sont produits par arbre (i.e. phénomène de masting), entrecoupées de productions beaucoup plus faibles (Auger-Rozenberg & Roques 2012). En cas de très faible production, une compétition plus intense pour la ressource peut alors être observée. Ainsi, l’invasion de cette punaise pourrait également constituer une menace pour les insectes qui se développent strictement aux dépens de la ressource « graines », ces espèces étant vulnérables aux facteurs qui affectent la production de graines. Pour déterminer, si L. occidentalis peut constituer une telle menace pour la faune indigène, il est intéressant d’étudier ses relations (et leurs conséquences) avec une espèce européenne telle que Pissodes validirostris, le charançon des cônes, considéré comme le principal ravageur des cônes de pins en Europe (Roques 1983).
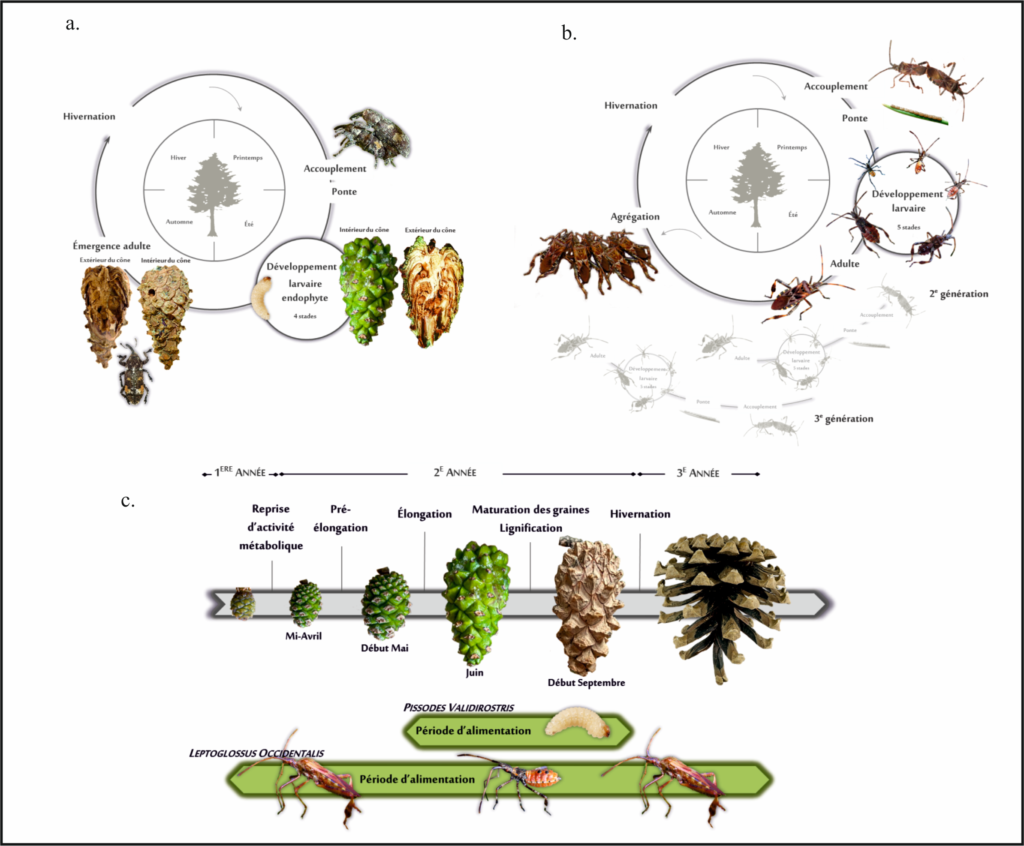
Figure 1. Cycles de développement : a) du charançon des cônes, Pissodes validirostris, et b) de la punaise prédatrice des graines de conifères, Leptoglossus occidentalis. c) Lien entre les périodes d’alimentation des deux espèces et le cycle de développement des cônes de Pin sylvestre, Pinus sylvestris.
Les interactions entre L. occidentalis et P. validorstris représentent un modèle intéressant de par les différences importantes observées dans leur cycle biologique ainsi que certaines caractéristiques propres à chaque espèce (Fig. 1). Alors que P. validirostris est strictement confiné aux pins (Roques 1983), L. occidentalis est polyphage ce qui rend cette espèce moins dépendante de son hôte. Bien qu’une nutrition de maturation des adultes ait lieu sur les rameaux ainsi que sur les cônes, ces dégâts sont non préjudiciables pour la production de graines. Seules les larves du charançon provoquent une destruction des tissues du cône, creusant à l’intérieur et consommant toutes les graines (Roques 1976; Lennox et al. 2009). Le développement larvaire ainsi que la nymphose s’effectuent à l’intérieur du même cône. Au contraire, le développement de L. occidentalis est entièrement ectophyte, adultes et larves insérant leurs stylets buccaux à travers les tissus du cône pour atteindre les graines dont ils digèrent le contenu (Bates et al. 2001). De plus, les punaises sont capables d’exploiter le cône sur l’ensemble de son cycle de développement, depuis la production du conelet jusqu’à la libération des graines. La période d’exploitation des cônes par le charançon pour la ponte correspond à une période très courte (Mai-Juin) (Roques 1976). En outre, le développement ectophyte de L. occidentalis permet aux larves de se déplacer sur l’arbre pour rechercher les meilleures conditions tandis que les larves de charançon ne peuvent pas se déplacer si les conditions viennent à changer et sont, par conséquent, tributaires du site d’oviposition. De même, les punaises adultes sont de bons voiliers, capables de voler sur de longues distances ce qui correspond à une différence avec P. validirostris. Les charançons adultes ne se déplacent que sur de courtes distances depuis la plante où ils ont effectué leur cycle larvaire (Annila 1975). Ainsi, les populations sont donc confinées à des zones restreintes et ce même lorsque les conditions ne sont pas optimales.
Etant donné ces différentes caractéristiques, L. occidentalis pourrait avoir un avantage compétitif sur P. validirostris notamment lors d’une faible production de cônes, pouvant ainsi mener au déplacement compétitif du charançon. Les premiers résultats obtenus préalablement vont dans ce sens. Si la punaise semble avoir un impact négatif sur le développement du charançon, on ne peut pour le moment pas exclure que ce dernier pourrait, lui aussi, avoir un impact négatif sur la punaise. Les expériences précédemment menées se sont concentrées sur le début du cycle de développement du charançon et ont montré que le développement du charançon était largement perturbé par la présence de Leptoglossus. Une expérience complémentaire avec une période d’accès aux cônes pour les punaises, répartie sur toute la période de développement du charançon, apparait donc nécessaire. L’objectif est ici de tester si des cônes infestés par le charançon sont exploitables par L. occidentalis tout au long du cycle de P. validirostris.
Méthodes
Les expériences ont été réalisées sur des Pinus sylvestris du peuplement de Chorges (Hautes-Alpes). Dix arbres (comportant des signes visibles d’infestation de P. validirostris) ont été sélectionnés et des cônes ont été ensachés dans des bonnettes en gaze. La moitié des bonnettes correspondait à des cônes infestés par P. validirostris (exsudation de résine, dépôt brun jaunâtre et premiers signes visibles d’attaque). Ces mêmes bonnettes ont ensuite été aléatoirement assignées aux deux modalités suivantes : les cônes ont été soumis à des larves de L. occidentalis (a) mi-Juillet et (b) fin Août. L’autre moitié des bonnettes, comportant des cônes non infestés par P. validirostris, a été soumise aux mêmes traitements (a) et (b). Chaque période d’accès aux cônes pour L. occidentalis était de 15 jours, période pendant laquelle un suivi de mortalité a été réalisé (chaque individu mort était remplacé). Aux traitements précédents s’ajoutaient deux traitements « contrôles » : (t1) les cônes n’ont pas été soumis à L. occidentalis seulement aux charançons et (t2) les cônes n’ont été soumis à aucun insecte. L’expérience était composée de dix répétitions par modalité / traitement. Les cônes ont été récoltés mi-Septembre. Les cônes ont été placés dans des tubes en plastique aérés permettant ainsi aux charançons d’émerger. Chaque cône a ensuite été disséqué. La dissection a permis de distinguer des larves de P. validirostris ou des adultes encore non émergés et restés dans leur logette de nymphose et donc, d’estimer la mortalité du charançon. Afin d’estimer d’éventuelles relations entre production et infestation, durant chaque période d’expérimentation, un suivi des populations naturelles de punaises a été effectué sur les mêmes arbres. Le nombre de cônes infestés par arbre a également été déterminé.
Résultats et discussion
Impact des relations sur Leptoglossus occidentalis : Une mortalité très importante des punaises a été observée pour la modalité a (i.e. mi-Juillet) et ce, quels que soient les traitements considérés (65,8% et 84,1%). Cette mortalité est à mettre en lien avec les fortes chaleurs observées au cours de cette période dans la région. Il a été démontré que les bonnettes génèrent un micro-climat en son sein, très certainement défavorable à l’insecte (Strong 2016). Les mortalités observées pour la modalité b (i.e. fin Août) sont, elles, bien moins importantes (3,3% et 19,5%). Cependant, la mortalité de Leptoglossus dans les traitements avec présence du charançon est significativement plus élevée qu’en son absence et ce pour les deux modalités (modalité a : χ2 = 7.8, P < 0.01 ; modalité b : χ2 = 4.1, P < 0.05 ; Fig 2).

Figure 2. Mortalité de Leptoglossus occidentalis exposée à des cônes infestés ou non par le charançon Pissodes validirostris.
Cette mortalité supérieure de Leptoglossus en présence du charançon laisse penser que le charançon a un impact négatif sur la punaise. En revanche, bien que la mortalité de la punaise en présence du charançon soit supérieure à celle observée en absence de charançon, la mortalité relativement faible de Leptoglossus en fin de cycle de développement du charançon est surprenante (Fig 2). En effet, une fois les larves (stades L3 et L4) de P.validirostris bien installées dans le cône, celui-ci ne constituerait pas une source de nourriture optimale pour L. occidentalis (Roques 1976). Leptoglossus pourrait donc être capable d’utiliser des ressources alternatives (piqûres sur les aiguilles, les quelques graines encore disponibles, etc.). Leptoglossus pourrait aussi être un prédateur facultatif comme observé pour d’autres punaises (Hagler et al. 2010).
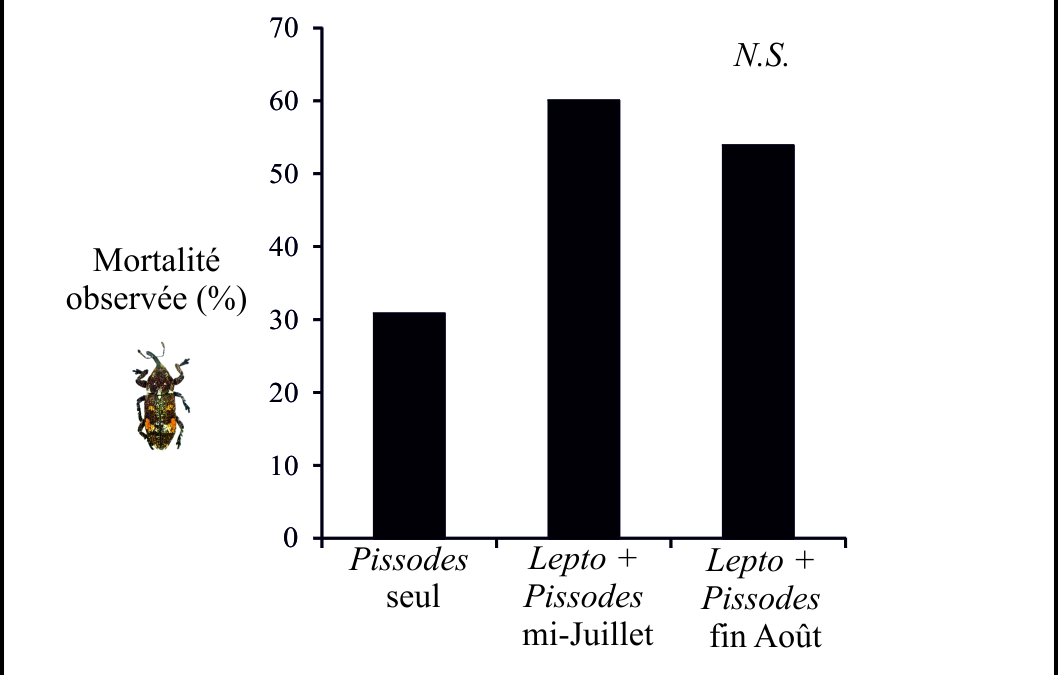
Impact des relations sur Pissodes validirostris : Une tendance à la surmortalité des charançons (développement larvaire avorté, incapacité des adultes à émerger du cône) en présence de Leptoglossus est suggérée par les résultats (Fig 3). Cependant cette surmortalité n’est pas supportée statistiquement (χ2 = 2.8, df = 2, P > 0.05). La prise alimentaire de Leptoglossus pourrait être à l’origine de cette surmortalité. Comme cité précédemment, cette surmortalité pourrait traduire un comportement de prédation facultative de la punaise. Cette dernière pourrait aussi être responsable de la rupture de processus physiologiques du cône (changements physico-chimiques, diminution de la valeur nutritive, etc.), ce qui altérerait le développement du charançon. En effet, le développement du charançon est intimement lié à celui du cône (Roques 1976).
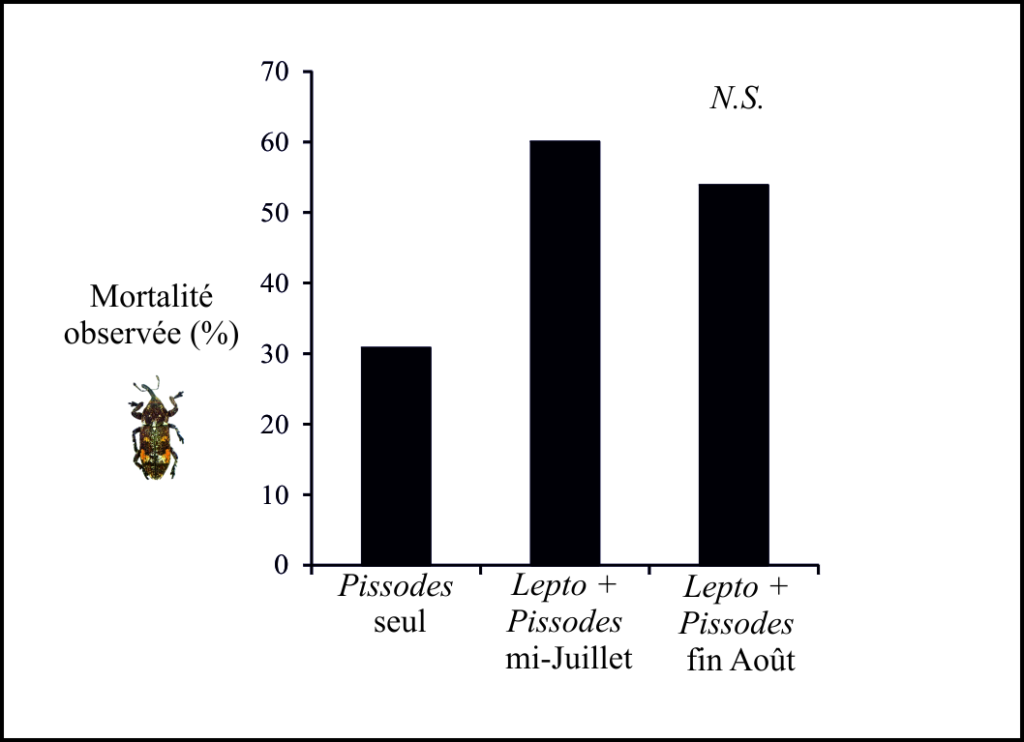
Figure 3. Mortalité de Pissodes validirostris dans des cônes exposés ou non à la punaise, Leptoglossus occidentalis.
Observations en peuplement naturel : La relation entre le pourcentage d’infestation de l’arbre par le charançon (i.e. le nombre de cône infesté par arbre) et le nombre de punaises observés sur ces mêmes arbres n’est pas corrélée (r² = -0.12 ; P > 0.05 ; Fig 4). Ce résultat semble donc indiqué que, pour des infestations faibles ou modérées, la présence du charançon n’est pas un frein pour Leptoglossus. Cependant, aucun arbre avec un taux d’infestation totale (ou très élevée) du charançon n’a été considéré ici. Il serait donc intéressant de reconduire ce suivi avec un nombre d’arbres plus important par catégorie d’infestation (i.e. faible, modérée, élevée, totale). En revanche, une relation entre le nombre de cônes produits par arbre et le nombre de Leptoglossus a été observée (r² = 0.62 ; P < 0.05 ; Fig 4). Leptoglossus semble donc privilégier les arbres les plus producteurs en cônes, contrairement au charançon qui ré-infeste souvent la plante sur laquelle il a effectué son développement (Annila 1975).
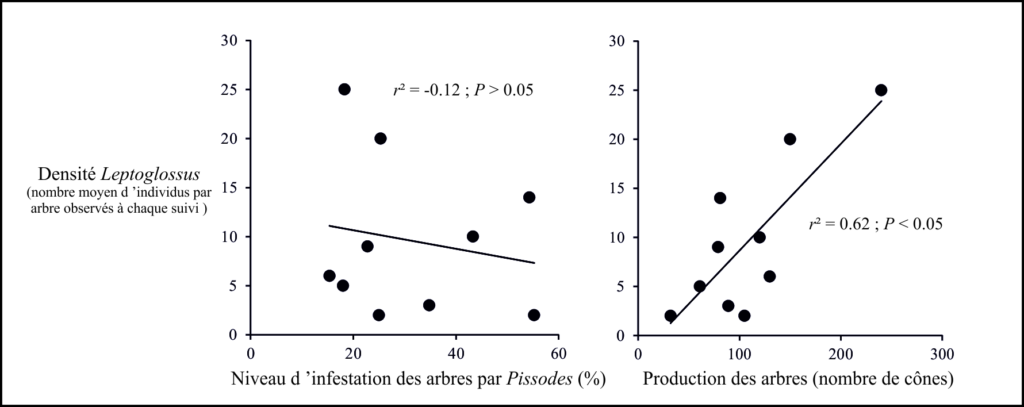
Figure 4. Relation entre la densité de Leptoglossus occidentalis et le niveau d’infestation du charançon, Pissodes validirostris, et la production de cônes de Pinus sylvestris.
Conclusion
Cette étude apporte les premiers éléments de discussion sur les nouvelles interactions interspécifiques créées depuis l’arrivée de L. occidentalis en Europe. Au vu des résultats, nous ne pouvons pas clairement statuer sur les relations entre la punaise invasive, L. occidentalis et le charançon natif, P. validirostris. En conditions contrôlées, les deux espèces semblent avoir un impact négatif l’une sur l’autre. Toutefois, en conditions naturelles, les deux espèces semblent cohabiter à la fois dans le même peuplement mais aussi sur le même arbre. Cette observation indique donc que les dégâts dus à Leptoglossus s’ajoutent à ceux du charançon. L’action combinée de ces deux ravageurs pourrait donc être un sérieux problème pour la régénération naturelle de certains peuplements. L’étude radiographique des graines extraites de chaque cône permettra de déterminer l’impact spécifique du charançon et de la punaise sur la production de graines. Pour cette dernière, des suivis précédents ont montré un impact pouvant être important dans ce peuplement (Lesieur et al. 2014).
Au-delà des relations charançon-punaise, les résultats apportent de nouvelles informations sur l’impact écologique des invasions biologiques (i.e. nouvelles interactions interspécifiques, impact potentiel sur la régénération) ce domaine ayant parfois été négligé aux dépens de la quantification de l’impact économique (Essl 2011 ; Kenis et al. 2009 ; Kenis & Branco 2010).
Je tiens à remercier Lucie Bertheau et Alexis Bernard pour leur aide technique ainsi que l’Unité de Recherche de Zoologie Forestière pour son soutien matériel. Je remercie bien évidement la Société Française d’Ecologie sans qui cette étude n’aurait pu se dérouler dans d’aussi bonnes conditions.
Références
Annila E (1975) The biology of Pissodes validirostris Gyll. (Col., Curculionidae) and its harmfulness, especially in Scots pine seed orchards.Metsantutkimuslaitoksen Julkaisuja, 85: 95p.
Auger-Rozenberg MA, Roques A (2012) Seed wasp invasions promoted by unregulated seed trade affect vegetal and animal biodiversity. Integrative Zoology, 7 (3):228-246
Bates SL, Lait CG, Borden JH, Kermode AR (2001) Effect of feeding by the western conifer seed bug, Leptoglossus occidentalis, on the major storage reserves of developing seeds and on seedling vigor of Douglas-fir. Tree Physiology, 21 (7):481 -487
Blatt SE, Borden JH (1998) Interactions between the Douglas-fir seed chalcid, Megastigmus spermotrophus (Hymenoptera: Torymidae), and the western conifer seed bug, Leptoglossus occidentalis (Hemiptera : Coreidae). The Canadian Entomologist, 130 (6):775-782
Essl F, Dullinger S, Rabitsch W, Hulme PE, Hulber K, Jarosik V, Kleinbauer I, Krausmann F, Kuhn I, Nentwig W, Vila M, Genovesi P, Gherardi F, Desprez-Loustau ML, Roques A, Pysek P (2011) Socioeconomic legacy yields an invasion debt. Proceedings of the National Academy of Sciences of the United States of America,108 (1):203-207
Fent M, Kment P (2011) First record of the invasive western conifer seed bug Leptoglossus occidentalis (Heteroptera: Coreidae) in Turkey. North-Western Journal of Zoology, 7 (1):72-80
Gandhi KJK, Herms DA (2010) Direct and indirect effects of alien insect herbivores on ecological processes and interactions in forests of eastern North America. Biological Invasions, 12 (2):389-405
Hagler JR, Jackson CG, Blackmer JL (2010) Diet selection exhibited by juvenile and adult lifestages of the omnivores western tarnished plant bug, Lygus hesperus and tarnished plant bug, Lygus lineolaris. Journal of Insect Science, 10:127
Kenis M, Auger-Rozenberg MA, Roques A, Timms L, Pere C, Cock MJW, Settele J, Augustin S, Lopez-Vaamonde C (2009) Ecological effects of invasive alien insects. Biological Invasions,11 (1):21-45
Kenis M, Branco M (2010) Impact of alien terrestrial arthropods in Europe. In: Roques A, Kenis M, Lees D et al. (eds) Alien terrestrial arthropods of Europe, vol 4(1). Pensoft, Sofia, BGR, 5:51 -71
Lennox CL, Hoffmann JH, Coutinho TA, Roques A (2009) A threat of exacerbating the spread of pitch canker precludes further consideration of a cone weevil, Pissodes validirostris, for biological control of invasive pines in South Africa. Biological Control, 50 (2):179-184.
Lesieur V, Yart A, Guilbon S, Lorme P, Auger-Rozenberg M-A, Roques A (2014) The invasive Leptoglossus seed bug, a threat for commercial seed crops, but for conifer diversity? Biological Invasions, 16 (9): 1833-1849
Reitz SR, Trumble JT (2002) Competitive displacement among insects and arachnids. Annual Review of Entomology, 47:435-465
Roques A (1976) Observations on the biology and ecology of Pissodes validirostris Gyll (Coleoptera, Curculionidae) in the forest of Fontainebleau. Annales de Zoologie, Ecologie Animale, 8 (4):523-542
Roques A (1983) Les insectes ravageurs des cones et graines de coniferes en France. Institut National de la Recherche Agronomique, Paris, 134 p.
Strong, W. (2016). Lodgepole pine seedset increase by mesh bagging is due to Leptoglossus occidentalis (Hemiptera: Coreidae) exclusion. Journal of the Entomological Society of British Columbia, 112, 3-18.
Vitousek PM, Dantonio CM, Loope LL, Rejmanek M, Westbrooks R (1997) Introduced species: A significant component of human-caused global

Commentaires récents