La Société Française d’Ecologie et d’Evolution (SFE2) vous propose ce regard de Raphaël Lami et Anne Teyssèdre, respectivement microbiologiste et écologue, sur la coopération par quorum sensing chez les bactéries et autres microorganismes.
Une version légèrement modifiée de cet article sera bientôt publiée et mise en ligne dans l’Encyclopédie de l’Environnement, nouveau partenaire de publication de ces ‘regards’.
MERCI DE PARTICIPER à ces regards et débats sur la biodiversité en postant vos commentaires et questions sur les forums de discussion qui suivent les articles; les auteurs vous répondront.
———-
Coopération par quorum sensing chez les bactéries
par Raphaël Lami(1) et Anne Teyssèdre(2)
(1) Maître de Conférences à Sorbonne Université, Laboratoire de Biodiversité et Biotechnologies Microbiennes, USR3579 SU-CNRS / Station marine de Banyuls, raphael.lami@obs-banyuls.fr
(2) Docteure en biologie évolutive, auteure et médiatrice scientifique en écologie et sciences de l’environnement. http://anne.teyssedre.free.fr/
Article édité par Sébastien Barot
——-
Mots clés : Comportement social, microorganismes, bactéries, communication, signaux chimiques (phéromones), quorum sensing, mécanismes, adaptation, évolution, microbiote, macrobionte, interactions, symbiose, quorum quenching, microbiologie environnementale.
——–
- Préambule : microbiotes et macrobiontes
- Un microbiote qui nous est cher…
- Un modèle historique
- A la recherche des composés impliqués et de leurs fonctions
- La nature des messagers chimiques : les bases du langage bactérien
- Les multiples usages du quorum sensing, chez de nombreux microorganismes
- Evolution et adaptation du quorum sensing
- Détournements et exploitation du signal
- Manipuler les dialogues moléculaires
- Conclusions et perspectives
- Glossaire
- Bibliographie
- Forum de discussion sur ce regard
Préambule : microbiotes et macrobiontes
Qu’ils soient plantes, animaux, macroalgues ou champignons, les organismes dits ‘macrobiontes’ que nous distinguons à l’œil nu hébergent tous à leur surface et dans certains organes des communautés abondantes de microbes comportant bactéries, champignons unicellulaires ou/et autres protistes*, éventuellement archées*. Peuplant des habitats biologiques bien précis tels que les racines d’un chardon, les follicules pileux d’un écureuil ou le tube digestif d’un termite – d’espèce bien déterminée, dans les trois cas-, ces communautés microbiennes dites ‘microbiotes’ sont non seulement adaptées aux conditions physiques et biologiques locales (température, pH, types de nutriments, autres micro-espèces) descriptives de leur habitat organique, dépendant en cela de leur hôte macroscopique, mais participent au fonctionnement de l’écosystème hôte-microbiote (dit parfois ‘holobionte’), dans son ensemble, par leur présence et leurs multiples activités métaboliques.
Plus encore, coévoluant avec l’espèce hôte depuis maintes générations – aux échelles temporelles des microorganismes et du macrobionte-, les membres d’un microbiote peuvent contribuer de manière importante au fonctionnement physiologique de l’espèce hôte, nouant ainsi une relation de dépendance réciproque ou symbiose* avec celle-ci.
Un microbiote qui nous est cher…
C’est le cas du microbiote du tube digestif des humains, récemment popularisé par le livre de Giulia Enders « Le charme discret de l’intestin » (Enders, 2015). Réunissant des représentants des trois grands branches du vivant que sont les bactéries*, les archées* et les eucaryotes*, ces derniers représentés notamment par des champignons unicellulaires, celui-ci comporte des milliers d’espèces, surtout bactériennes, et compte des centaines de milliards de cellules… soit environ autant que leur hôte, pour un volume et un poids 20 à 50 fois inférieurs (car les bactéries sont beaucoup plus petites que les cellules humaines, eucaryotes*).
Logés et nourris par leur partenaire écologique, les microorganismes du tube digestif humain exercent en retour une activité généralement bénéfique pour ce dernier. Par exemple, de nombreuses espèces de bactéries (telle Helicobacter pylori) s’activent à couper les grosses molécules potentiellement nutritives mais indigestes, telles que protéines animales ou amidon, en petites molécules (acides aminés, courts peptides, glucose..) aptes à franchir par diffusion la barrière intestinale, participant ainsi à l’alimentation de leur hôte. D’autres synthétisent et sécrètent des vitamines et autres oligoéléments essentiels pour leur hôte. D’autres encore, telles Lactobacillus sp. ou Bifidobacteria sp., bloquent par leur présence l’accès de l’épithélium intestinal à des bactéries pathogènes telles que salmonelles et Listeria, tandis que des champignons unicellulaires sécrètent dans le microbiome des composés toxiques pour d’autres bactéries pathogènes…
Impliqués dans des boucles de réaction généralement stabilisatrices et des modules fonctionnels éprouvés par la sélection naturelle, chez l’espèce-hôte, les réseaux d’espèces microbiotiques peuvent réguler de nombreuses fonctions physiologiques de leur hôte. A contrario, leur altération radicale peut causer de nombreuses pathologies chez les organismes hôtes telles que, dans le cas du microbiote humain, l’obésité, le diabète ou des ulcères intestinaux – voire des maladies très graves comme la listériose.
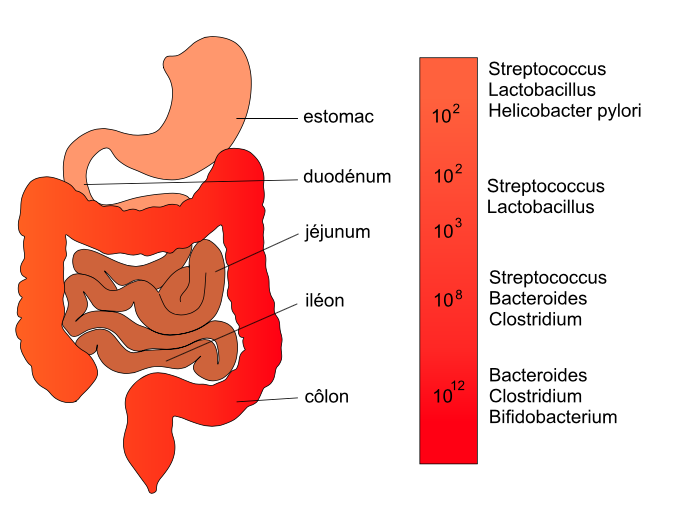
Figure 1 : Composition et concentrations approximatives (en cfu/ml) des espèces bactériennes dominantes le long du microbiote digestif humain (adapté de Sartor RB, Gastroenterology, 2008). Pancrat CC BY-SA 3.0.
Macrobionte et microbiote sont ainsi alliés… jusqu’à un certain point ! Si la relation n’est pas toujours bénéfique aux deux parties, c’est notamment parce qu’à la différence du premier -issu de la division cellulaire d’une unique cellule-, le second n’est pas un organisme individuel, ni un ‘super organisme’ agissant à l’unisson. Appartenant à de nombreuses espèces différentes, les cellules d’un microbiote sont engagées dans de multiples relations écologiques et métaboliques, entre elles et avec leur hôte. Elles synthétisent ou dégradent et sécrètent dans le milieu extérieur de nombreux composés chimiques, qui ont des effets variés sur les autres cellules alentour, ainsi que sur leur hôte. Elles peuvent ainsi communiquer entre elles via des signaux chimiques (dits phéromones) et coopérer par la mise en commun d’outils moléculaires (ex : enzymes ‘digestives’, sidérophores..) ; mais aussi se combattre via l’émission de composés toxiques, par exemple (cf. par ex. West et al. 2007 ; Sung et al. 2017). Toutes activités pouvant stabiliser la relation mutualiste* entre l’hôte et son microbiote, mais parfois aussi conduire à une attaque de l’hôte par ce dernier ! (Voir plus bas.)
Les ‘dialogues moléculaires’ entre cellules d’un microbiote sont complexes, comme le montrent les recherches des vingt dernières années dans le domaine. Parmi les signaux/messages chimiques émis par les bactéries, certains stimulent la coopération entre bactéries réceptrices, dans certaines conditions seulement, selon un mécanisme nommé ‘quorum sensing’ (ou ‘évaluation du quorum’) étudié notamment au Laboratoire de Banyuls et que nous allons présenter dans cet article. D’un point de vue microbiologique, appliqué à la médecine et à la santé publique, la compréhension des mécanismes en jeu dans cette coopération conditionnelle ouvre de nombreuses perspectives, déjà prometteuses. En outre, l’exploration des mécanismes et enjeux du ‘quorum sensing’ bactérien paraît très intéressante, au plan théorique et évolutionniste, car elle permet d’explorer l’évolution de la coopération chez les bactéries (ex : West et al. 2006, Diggle et al. 2007a).
Un modèle historique : les bactéries bioluminescentes de la seiche Euprymna scolopes
La bioluminescence produite par certains organismes marins est indiscutablement l’un des phénomènes les plus fascinants observable dans les océans. Elle a été en particulier bien étudiée chez un organisme modèle, une petite seiche (ou sépiole) nommée Euprymna Scolopes que l’on trouve à Hawaii. Celle-ci possède, disséminés sur son manteau, de multiples petits organes lumineux dits photophores, dont l’activité varie en fonction de l’éclairage local, de leur position (dorsale ou ventrale) et du comportement de la seiche.

Fig. 2a : La petite seiche Euprymna scolopes
(Cliché: Margaret McFall-Ngai. CC BY 4.0)
Lorsque celle-ci chasse au clair de lune, la bioluminescence des photophores réglée sur l’intensité de l’éclairage apical (venant d’en haut) lui permet de compenser le déficit de lumière sur sa face ventrale et de masquer son ombre portée. C’est ainsi que, paradoxalement, émettre de la lumière permet à la sépiole de dissimuler sa présence aux yeux de ses ennemis, prédateurs et proies (Marshall, 2009). Un comportement très adaptatif ! Mais les cellules productrices de lumière, dans les photophores, n’appartiennent pas à la seiche : ce sont des bactéries symbiotiques de l’espèce Vibrio fischeri, capables de bioluminescence, qui coordonnent leur production de lumière sous contrôle du système neuroendocrinien de leur hôte. Ce faisant, les bactéries augmentent la probabilité de survie de la seiche qui les héberge et son succès de reproduction.
Il s’agit là en somme d’un ‘service écologique’ rendu par les bactéries V. fischeri aux seiches qui les hébergent. Ce service, cependant, a un coût énergétique a priori pénalisant pour les bactéries individuelles au plan adaptatif – car l’énergie utilisée pour la synthèse de luciférase est perdue pour leurs autres activités vitales et de reproduction. Si ce comportement coopératif et ‘altruiste’ des bactéries a pu évoluer au fil des générations, c’est parce qu’en augmentant la survie de la seiche via l’émission coordonnée de lumière, les bactéries augmentent leur propre probabilité de survie et celle de coloniser une autre seiche. Elles augmentent ainsi leur propre valeur sélective* ! (Voir plus bas, cependant, pour une exploration plus complète du mécanisme).

Fig. 2b : Bioluminescence produite par Vibrio fischeri en culture (Cliché: Margot Doberva, Station marine de Banyuls)
Au début des années 1970, il a été montré que les bactéries Vibrio fischeri ne synthétisent l’enzyme luciférase nécessaire à la production de lumière que lorsque leur concentration atteint un seuil, ou quorum, que les bactéries sont capables de détecter (Nealson et al. 1970). Ce phénomène a été alors nommé quorum sensing. Il désigne un système de communication (chimique) entre cellules d’une population de bactéries, ou d’autres microorganismes, par lequel celles-ci s’informent mutuellement de leur densité locale, et qui permet le déclenchement et la coordination d’activités collectives à partir d’une certaine densité. Les bactéries présentent alors un comportement coopératif ou ‘social’, et sont capables de synchroniser l’expression de fonctions spécifiques à l’échelle d’une population de cellules microbiennes. Dans le cas des bactéries symbiotiques de la seiche, la fonction ainsi contrôlée est la production de lumière (bioluminescence).
Le mécanisme est assez simple. Les bactéries capables de quorum sensing synthétisent et libèrent dans le milieu extérieur de petites molécules organiques jouant le rôle de signaux chimiques (phéromones), auxquelles elles sont elles-mêmes sensibles. La liaison du signal chimique avec un récepteur spécifique de la cellule (récepteur membranaire ou cytoplasmique, selon l’espèce) stimule entre autres synthèses et sécrétions celles de la phéromone elle-même. [Sachant que les bactéries impliquées sont tout à la fois émettrices et réceptrices de ces signaux, les microbiologistes parlent à ce sujet d’« autoinduction » et désignent du terme d’« autoinducteurs » les signaux chimiques du quorum sensing (cf. Miller et Bassler, 2001).]
La concentration locale des signaux chimiques du quorum sensing (QS) varie donc avec la densité des bactéries – ou, plus généralement, des microorganismes engagés dans un QS. A faible densité cellulaire, la concentration des molécules-signaux dans le milieu extracellulaire est très faible, peu sont détectées par les cellules cibles avant d’être dégradées ou localement éliminées par diffusion ; le mode de fonctionnement (ou phénotype) des bactéries reste donc stable, de type ‘individualiste’. Mais à partir d’un certain seuil de densité, du fait de la boucle d’autoinduction (i.e., la réception du signal chimique par une bactérie stimulant chez celle-ci la synthèse et l’émission du même signal), la concentration locale de ces molécules fait basculer les cellules vers un autre mode de fonctionnement (ou phénotype), impliquant la synthèse d’autres molécules utiles à l’ensemble du groupe et favorisant leur coordination : un phénotype dit ‘social’ ou ‘coopératif’.
Notons que le seuil de densité du QS varie avec l’ensemble des facteurs qui affectent la concentration locale des signaux moléculaires. En particulier, la vitesse de disparition locale de ces phéromones augmente avec la vitesse d’écoulement du fluide extracellulaire. La boucle d’autoinduction du QS permet donc aux bactéries échangeuses de signaux de ‘choisir’ leur mode de fonctionnement (individualiste ou coopératif) en fonction de conditions environnementales (concentration locale des molécules-signaux) intégrant en un seul facteur la concentration locale des bactéries et la stabilité physique et biochimique du milieu.
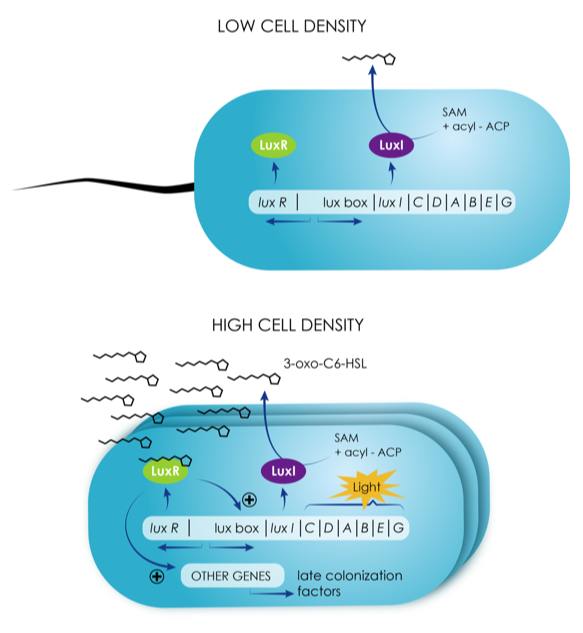
Figure 3 : Principe du quorum sensing (QS). Voir texte ci-dessous. (Dessin : Carole Petetin pour e-marin’lab, https://emarinlab.obs-banyuls.fr/ )
Figure 3 : Principe du quorum sensing (QS). A faible densité cellulaire (en haut), la faible concentration des signaux chimiques du QS (« autoinducteurs ») se liant à un récepteur cellulaire avant d’être localement éliminés n’a que peu d’effet sur les cellules, qui en réponse ne synthétisent et n’émettent que peu de signaux. Au-delà d’un certain seuil, la concentration des signaux émis suffit pour stimuler le basculement des cellules vers un autre mode de fonctionnement, de type ‘social’, impliquant une importante modification de l’expression génique. Dans le cas illustré ici, l’enzyme LuxI gouverne la synthèse des signaux du QS, le récepteur LuxR les capte et régule l’expression des gènes lux, impliqués dans la production de bioluminescence.
A la recherche des composés impliqués et de leurs fonctions
La recherche et l’identification des composés impliqués dans le quorum sensing, ainsi que la caractérisation des fonctions qu’ils régulent, requièrent de coupler de nombreuses approches expérimentales de disciplines différentes: chimie des substances naturelles, biologie cellulaire, biochimie, génétique ou bien encore génomique. La faible concentration de ces composés rend leur recherche très difficile sur des échantillons naturels (Hmelo & Van Mooy 2009). Aussi ces composés sont-ils souvent étudiés chez des souches représentatives, des modèles microbiens. L’une des premières étapes est de vérifier que ces souches en collection sont capables de produire des molécules de quorum sensing, à l’aide d’organismes génétiquement modifiés nommés biosenseurs. Ces derniers sont capables d’émettre une fluorescence ou une coloration violette en présence d’autoinducteurs.
Si ces biotests se révèlent positifs, les approches de la chimie des substances naturelles (Chromatographie en Phase Gazeuze (CPG) ou Chromatographie Liquide Haute Performance (HPLC), couplée à de la Spectrométrie de Masse (MS/MS) et de la Résonance Magnétique Nucléaire (RMN) permettent de caractériser les composés produits. L’identification des fonctions régulées par ces composés repose souvent sur la production de mutants des voies de quorum sensing chez les souches modèles étudiées, c’est à dire que l’on inactive les gènes impliqués dans les dialogues moléculaires. Ensuite, les phénotypes induits chez ces mutants sont caractérisés, c’est à dire que l’on observe attentivement le comportement, la croissance, la réponse du microorganisme chez lequel ces gènes sont inactivés (Rolland et al., 2016).
La nature des messagers chimiques : les bases du langage bactérien
D’importants efforts ont été réalisés par des équipes de microbiologistes et de chimistes pour caractériser la nature des signaux chimiques impliqués dans le quorum sensing. Ces travaux ont montré l’importance des homosérines lactones dans ces échanges (Eberhard et al., 1981). Il s’agit de petites molécules organiques formées d’un noyau lactone et d’une chaine carbonée dérivée d’acides gras (cf. Fig. 3). Elles sont très diversifiées : la longueur de la chaine, la présence de doubles liaisons ou de groupements cétones, etc… permettent de moduler le langage moléculaire. Plus récemment, il a été démontré aussi l’importance du diester de borate furanosylé dans ces échanges, une petite molécule à deux cycles carbonés qui contient un atome de bore (Chen et al., 2002). Depuis, de nombreux autres composés ont été identifiés, mais les microbiologistes s’accordent pour estimer que l’on ne connaît encore qu’une infime fraction des signaux chimiques échangés lors de leur quorum sensing par les cellules microbiennes. L’un des problèmes majeurs pour les chercheurs est que ces composés sont émis en quantités très faibles, rendant leur identification particulièrement difficile.
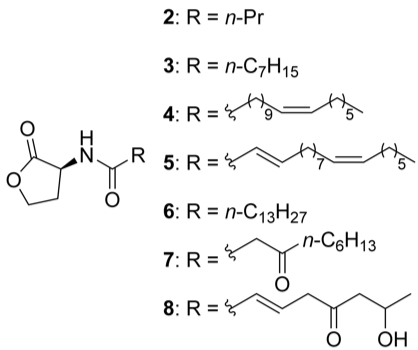
Fig.4 : Quelques exemples d’acyl-homosérines lactones
Les multiples usages du quorum sensing, chez de nombreux microorganismes
Depuis les années 1980, l’utilisation du quorum sensing pour la synchronisation et coordination d’activités collectives a été vérifiée chez de très nombreuses bactéries (cf. par ex. West et al. 2007). Elle a aussi été mise en évidence chez des archées (Zhang et al. 2012) et chez certains champignons saccharomycètes ‘dimorphiques’, présentant deux modes de croissance alternatifs (de type mycelium ou bourgeonnant) (Hornby et al. 2001 ; Albuquerque & Casadevall 2012).
Le quorum sensing contrôle de nombreuses fonctions chez ces microorganismes, avec d’importantes conséquences pour le fonctionnement du microbiote et la physiologie de l’hôte (e .g. Miller & Bassler 2001 ; West et al. op.cit. ; Albuquerque & Casadevall 2012 pour les champignons dimorphiques). Par exemple, au laboratoire de Banyuls, l’équipe de l’un d’entre nous (RL) s’interroge -avec d’autres équipes en France- sur le rôle du quorum sensing chez certaines souches de Vibrio appartenant au microbiote des huîtres et pouvant devenir pathogènes dans certaines conditions.
De nombreux microorganismes contrôlent leur pathogénicité par quorum sensing : c’est le cas de bactéries pathogènes de plantes (Erwinia sp.), de la peau (par exemple le Staphylocoque doré, Staphylococcus aureus), de l’agent du choléra (Vibrio cholerae), ainsi vraisemblablement que du champignon dimorphique Candida albicans. Chez d’autres bactéries, telles Echerichia coli et Klensiella sp., le quorum sensing contrôle la résistance collective aux antibiotiques assurée par la production et sécrétion d’enzymes (lactonase, notamment) capables de briser les molécules antimicrobiennes. De manière plus générale, chez de nombreuses bactéries, il contrôle l’acquisition collective de nutriments ou/et l’agression de cellules de l’hôte par production et sécrétion dans le milieu extérieur de protéases et autres enzymes (dites « exo-enzymes ») capables de scinder des protéines, fragments d’ADN, macrolipides et autres chaînes hydrocarbonées en petites molécules assimilables, capables de traverser par simple diffusion la membrane des cellules bactériennes (ainsi que celle d’autres cellules).
Le QS est également impliqué dans la formation de biofilms isolants et protecteurs pour les populations bactériennes : dans ce cas, il stimule la synthèse de grosses molécules (souvent polysaccharides ou peptidoglycanes) coûteuses à produire par les bactéries individuelles et sans effet positif sur le fonctionnement de bactéries éparses ou peu nombreuses, mais à l’abri desquels les cellules peuvent se multiplier et coopérer plus efficacement dans l’exploitation de leur hôte ou de leur support minéral. Citons les biofilms bactériens qui bouchent les canalisations, qui recouvrent nos dents avant de se calcifier en tartre, qui adhèrent aux coques des bateaux, … Le quorum sensing bactérien est ainsi à l’origine d’infections chroniques chez les patients atteints de mucoviscidose (infections à Pseudomonas sp.).

Fig. 5 : Biofilm algal-bactérien sur un plan d’eau stagnante. (Cliché F. Lamiot, CC BY-SA 2.5 )
Evolution et adaptation du quorum sensing
Comment expliquer l’existence et l’évolution d’un tel système de communication sociale chez de nombreuses bactéries, archées et autres microorganismes peuplant des habitats isolés tels que les microbiomes ? Dans une approche tout à la fois écologique, génétique et évolutive, on peut souligner que la formation de communautés microbiennes denses dans des habitats locaux riches en nutriments, jointe au mode de fonctionnement habituel des microorganismes (modes d’alimentation, de reproduction, de défense, de communication..) favorisent l’évolution de tels systèmes.
De manière générale, la densité des cellules dans les microbiotes augmente la fréquence et la diversité des interactions chimiques et biophysiques entre espèces et à l’intérieur des populations de même espèce, interactions potentiellement avantageuses ou au contraire délétères pour les individus (en termes de valeur sélective*). Elle favorise donc l’évolution de multiples systèmes de communication s’appuyant sur ces interactions, systèmes dédiés à la coopération ou au contraire à l’évitement des partenaires écologiques (ex : Teyssèdre 1993, 2006 ; Maynard Smith et Harper, 2003).
Par ailleurs, qu’elles soient confinées dans un organe de leur hôte macroscopique ou concentrées autour d’une source de nutriments, l’isolement (même relatif) des communautés microbiennes augmente quant à lui la consanguinité des populations locales de même ‘espèce’ – c-à-d., dans le cas des bactéries, de populations issues du clonage d’individus et d’échanges de gènes entre lignées. Il favorise donc l’évolution de comportements sociaux au sein de ces populations locales (Hamilton 1964, Maynard Smith 1989).
[Schématiquement, si les individus en interaction locale sont apparentés, des comportements ‘‘altruistes’’ ou sociaux bénéficieront à la transmission de leurs gènes communs, dont les gènes sous-tendant ces comportements. A l’inverse, si ces individus ne sont pas apparentés, cela facilite l’apparition d’individus ‘‘tricheurs’’ n’ayant pas ces comportements sociaux, mais bénéficiant du comportement altruiste des autres individus. Cela freine ou empêche l’évolution de ces comportements sociaux. (Note de l’éditeur)]
Au niveau d’intégration supérieur, en outre, les cellules d’un microbiote sont des ingénieurs de leur écosystème : leur densité locale est telle que, par leurs multiples activités métaboliques, elles modifient considérablement leur environnement biophysicochimique (à l’échelle de leur hôte). En retour, les modifications du milieu causées par l’activité collective de très nombreuses cellules favorisent l’émergence, l’évolution et le contrôle de comportements sociaux adaptatifs pour les individus en condition de forte densité (e.g. West et al, 2007).
A l’instar de tous les comportements caractéristiques des espèces, ou de certaines catégories d’individus au sein des espèces – les juvéniles par exemple, ou les adultes reproducteurs, chez les animaux-, les signaux de communication et les comportements sociaux n’évoluent que s’ils augmentent la valeur sélective inclusive* des individus qui les performent.

Fig 6 : Meute de loups (Cliché Eric Kilby, CC BY-SA 2.0)
C’est le cas de la chasse collective des loups ou de la défense collective des suricates par exemple, qui n’impliquent dans les deux cas que les adultes et subadultes d’un groupe social (individus pour la plupart apparentés aux juvéniles du groupe). Il en va de même pour les activités bactériennes contrôlées par quorum sensing – même si les groupes coopératifs de bactéries comptent beaucoup plus de membres que les meutes de loups!
Pour être efficace et bénéficier à leur hôte sépiole (dont la survie et la reproduction favorise celle des bactéries hébergées, voir plus haut), l’émission de lumière par des bactéries V. fischeri doit être massive et synchronisée. La synthèse de luciférase et les chaînes de réactions impliquées dans l’émission de lumière, cependant, sont des activités physiologiques très coûteuses en énergie, pénalisantes au plan adaptatif (pour les bactéries) lorsqu’elles sont sans effet, c’est-à-dire dans le cas de bactéries peu nombreuses ou/et mal coordonnées. En bref, ces activités ne sont adaptatives pour les bactéries que dans certaines conditions de densité.
De la même manière, la synthèse et la sécrétion dans le milieu extérieur, par des bactéries en mode ‘social’, de grosses molécules coûteuses en énergie telles qu’enzymes, polysaccharides, sidérophores et autres « outils moléculaires », utiles à la collectivité, ne bénéficient aux bactéries sécrétrices (en termes de valeur sélective inclusive*) que si celles-ci sont entourées de nombreuses cellules agissant de même, souvent issues du même clone. Il s’agit en d’autres termes de production et mise à disposition d’autres cellules de « biens publics » coûteux à produire (cf. West et al., op. cit.), activités qui ne peuvent qu’être contre-sélectionnées en l’absence de réciprocité.
Dans ces conditions, l’évolution d’un système de communication et stimulation réciproque permettant aux collaborateurs potentiels de s’informer sur leur densité locale -via l’émission et la détection de petites molécules-signaux- et de coopérer à forte densité, ne peut qu’être favorisée par la sélection naturelle. Au plan évolutif, le basculement des bactéries vers un comportement coopératif est favorisé lorsque les bénéfices de ce comportement, en termes de valeur sélective, excèdent ses coûts.

Fig7 : Production collective de fibres amyloïdes par des bactéries E. coli pathogènes. A gauche (A), population d’Echerichia coli non pathogènes. A droite (B), libération de macromolécules amyloïdes (dites curli) par une souche de bactéries Echerichia coli pathogènes (résistantes aux antibiotiques usuels), vraisemblablement déclenchée par quorum sensing. [Cette synthèse et libération collective de fibres amyloïdes permet l’adhésion des bactéries aux cellules de leur hôte animal (macrobionte) et induit la formation d’un biofilm, ce qui favorise l’infestation des cellules de l’hôte.] Source : USDA (Pina Fratamico Microbiologist/Lead Scientist)
Détournements et exploitation du signal
Chez les microorganismes, comme chez les animaux ou les végétaux, tout système de communication ne peut évoluer -et éventuellement se stabiliser- que s’il favorise une interaction fonctionnelle entre deux ou plusieurs parties (partenaires de reproduction, congénères sociaux, partenaires écologiques, compétiteurs alimentaires ou sexuels…), au bénéfice de chacune d’elles (voir par exemple Maynard Smith et Harper, op. cit. ; Teyssèdre op. cit.). Les partenaires de communication peuvent alors être désignés comme l’émetteur et le ou les ‘destinataires biologiques’ des signaux.

Fig 8 : Pouillot siffleur clamant son territoire, dans une forêt. (Cliché Frédéric Jiguet)
Emetteurs et ‘destinataires biologiques’, cependant, n’occupent pas seuls leur habitat : ils côtoient de nombreux autres organismes, potentiels détecteurs et utilisateurs de toute information (et de toute ressource matérielle potentielle) véhiculée par les manifestations chimiques, visuelles, sonores, etc., des espèces présentes. Les vocalises d’un pouillot perché sur une branche, par exemple, sont entendues tout autant par la martre chasseuse et par les promeneurs humains que par les membres de son espèce auxquels il s’adresse (partenaire sexuelle actuelle ou potentielle, rivaux sexuels, ..).
L’émission d’un signal n’évolue que si son effet chez l’ensemble des organismes qui le perçoivent et y réagissent –qu’ils soient partenaires fonctionnels ou non- est globalement bénéfique aux émetteurs (en termes de valeur sélective inclusive)… dans les conditions de vie habituelles des espèces. Cela n’interdit pas pour autant la détection, l’exploitation ou/et l’éventuel détournement de signaux par d’autres organismes, partageant le même habitat, auxquels ils ne sont pas destinés. Et c’est bien sûr le cas pour le quorum sensing bactérien.
L’existence de souches bactériennes mutantes, insensibles aux signaux de quorum sensing de leurs congénères, a été mise en évidence par chez diverses espèces. Dispensés des synthèses coûteuses en énergie de leur congénères ‘sociaux’, mais bénéficiant des activités enzymatiques et des outils moléculaires (dits ‘biens publics’) libérés dans le milieu extérieur par ces derniers, ces mutants inconditionnellement individualistes sont à court terme plus compétitifs que leurs congénères sociaux, et se répandent initialement dans les populations. Ce sont en d’autres termes des ‘tricheurs’, qui parasitent un système de communication et coopération auxquels ils ne contribuent pas (ex : Diggle et al. 2007b, Sandoz et al. 2007).
La fraction croissante de ces ‘tricheurs’, cependant, réduit progressivement la densité locale des cellules en mode social. Elle réduit donc tout à la fois la productivité du groupe (entravant le fonctionnement collectif de la population locale) et la densité des signaux de quorum sensing, ce qui à terme met fin à la coopération locale (Popat et al., 2012).
Ainsi, en laboratoire, l’invasion d’une population de bactéries Pseudomonas aeruginosa par des mutants insensibles aux signaux chimiques du quorum sensing réduit l’épaisseur du biofilm protecteur formé par les bactéries en mode social, augmente la sensibilité aux antibiotiques de la population locale et réduit la réponse des bactéries ‘sauvages’ (i.e. potentiellement sociales) au quorum sensing (Popat et al. 2012, 2015). En outre, cette réponse varie dans le sens inverse de la parenté (proximité génétique) des bactéries mises en présence dans ces expériences : conformément à la règle de Hamilton (op.cit.), l’éloignement génétique réduit la coopération des individus.
L’exploitation des signaux de quorum sensing émis par les bactéries n’est bien sûr pas l’exclusivité de mutants ‘tricheurs’ insensibles à ces signaux, apparaissant de temps à autre dans les lignées bactériennes. En théorie, la sélection naturelle doit favoriser l’utilisation ou le détournement d’un signal chez toute espèce fréquentant le même habitat susceptible de percevoir ce signal, et chez l’espèce-hôte elle-même dans le cas d’interactions macrobiote-microbiontes, dès lors que cette utilisation augmente le succès de reproduction moyen des individus (voir plus bas). Il ne s’agit pas là -ou pas encore- de communication, mais bien d’exploitation d’un système de communication préexistant, dont l’évolution exercera en retour une pression de sélection sur les émetteurs ou/et destinataires biologiques du signal (cf. par ex. Maynard Smith et Harper 2003, et voir plus bas).
Manipuler les dialogues moléculaires
Les composés impliqués dans le quorum sensing contrôlent des fonctions importantes chez les microorganismes et souvent nuisibles pour l’homme, comme la pathogénicité ou la capacité à former des biofilms. De nombreuses équipes de recherche ont pour ambition de manipuler ces dialogues moléculaires pour contrôler, limiter ou stopper ces activités microbiennes. L’enjeu est d’autant plus important que la résistance des microorganismes aux antibiotiques connus est croissante. La recherche de stratégies alternatives de lutte est donc essentielle (Choudhary & Schmidt-Dannert 2010).
Pour atteindre cet objectif, les chercheurs s’inspirent (dans une démarche biomimétique ou/et évolutionniste) des stratégies d’exploitation de signaux observées dans la nature. On sait aujourd’hui que de nombreuses espèces notamment hôtes sont capables d’inhiber les dialogues moléculaires de quorum sensing entre cellules microbiennes: ce phénomène est appelé quorum quenching, ou étouffement du quorum.

Figure 9 : Algues rouges Delisea pulchra
(Copyrights Observatoire de Banyuls-Sorbonne Université)
L’un des plus célèbres exemples a été mis en évidence par des chercheurs australiens chez l’algue rouge Delisea pulchra, qui émet des molécules ressemblant fortement aux signaux de quorum sensing émis par les bactéries qui la colonisent en surface (des composés analogues nommés furanones), mais qui au lieu d’activer une réponse biologique chez les bactéries cibles, vont en fait l’inactiver. Ainsi, l’algue lutte contre le développement de biofilm et de bactéries pathogènes sur la surface de ses frondes (Gram et al., 1996, Rasmussen et al., 2000). Ces composés analogues sont maintenant testés comme biocides et des laboratoires tentent de les modifier chimiquement pour les rendre encore plus efficaces. Des stratégies similaires sont aussi testées pour tenter de lutter contre des pathogènes de plantes ou d’algues, dans des contextes très variés.

Specimen de Delisea japonica, alias Delisea pulchra, au Muséum d’Histoire Naturelle de Tokyo (Cliché Daderot, CC)
Les applications du quorum quenching sont donc multiples, et beaucoup ne sont encore qu’au stade expérimental. Certaines équipes ont utilisé des bactéries du genre Bacillus pour lutter contre des pathogènes de poisson en aquaculture (Defoirdt et al., 2004, 2011). Ces bactéries sécrètent des enzymes dégradant les messagers de quorum sensing. Ajoutées à l’aide de petites billes dans la nourriture des poissons, elles permettent de lutter en bassin d’aquaculture ou en aquarium contre les pathogènes, par la dégradation des messagers chimiques contrôlant leur coordination. D’autres tentent des stratégies proches pour lutter contre les biofilms qui se développent sur les membranes de filtration dans l’industrie (Oh et al., 2012).
Certaines perspectives semblent particulièrement prometteuses en médecine. Il est connu que les antibiotiques modifient de façon importante notre flore intestinale. Les déséquilibres induits peuvent favoriser l’apparition de certains pathogènes et maladies. Mais une étude récente (Thompson et al., 2015) a aussi permis de montrer que l’injection d’une bactérie surproductrice d’une molécule de quorum sensing (l’AI-2) dans l’intestin d’une souris permet de contrôler les populations microbiennes qui s’y développent. Ainsi, certains chercheurs ont-ils pu montrer qu’après un traitement antibiotique néfaste pour la microflore, l’injection de cette souche permettait de retrouver un microbiote plus diversifié.
Conclusions et perspectives
L’union fait la force, dit-on. Cette maxime semble une évidence, presque une lapalissade, à nos yeux humains : les comportements sociaux, la coopération, l’organisation entre congénères ou alliés permettent de réaliser à plusieurs des actions bénéfiques à l’ensemble des participants, mais hors de portée d’individus indépendants, agissant chacun pour soi.
Cependant, même dans le règne animal qui se distingue en ce domaine, coopérer n’est pas une règle d’or. A l’inverse des cygnes et de la plupart des oiseaux, les canes Colvert élèvent seules leurs petits. Proches cousins des lions, les tigres chassent en solo. Si l’Abeille domestique est très sociale (eusociale), de nombreuses espèces d’abeilles sont solitaires… Force est de reconnaître et de questionner les multiples rôles de l’environnement physique, biologique et social dans l’évolution des comportements ‘altruistes’ et de la communication (cf. par ex. Krebs & Davies 1991, 1997). Il en va de même pour les microorganismes.
De manière générale, coopérer comporte des coûts et des risques. Ne serait-ce que ceux associés à l’émission des signaux de communication et à la détection de ces signaux par des organismes non destinataires, peu enclins à collaborer : compétiteurs, prédateurs, parasites (e.g. Maynard Smith & Harper, 2003; Teyssèdre, 1993, 2006). C’est pourquoi le comportement social et la coopération ne peuvent évoluer que si les bénéfices – en termes de valeur sélective, c’est-à-dire de transmission de gènes aux générations suivantes – excèdent ces coûts. D’où l’évolution du quorum sensing chez nombre de bactéries, qui peuvent ainsi passer d’inoffensives à pathogènes pour leur hôte selon l’efficacité de ses défenses ou/et du contexte microbiotique par exemple ; d’où l’apparition et le développement épisodique mais à court terme de ‘tricheurs’ insensibles aux signaux sociaux, dans les populations bactériennes contrôlant leur coopération par quorum sensing ; et d’où l’évolution du ‘quorum quenching’ chez les espèces hôtes ou compétitrices de ces bactéries.
Dans les recherches appliquées à la médecine, l’étude des interactions microbiennes est un sujet de recherche en pleine évolution. La caractérisation des messagers chimiques impliqués, l’identification des fonctions microbiennes qu’ils gouvernent restent des enjeux de la recherche actuelle. Cette étude est particulièrement importante lorsque l’on cherche à comprendre le rôle du microbiote associé aux macroorganismes, car ces interactions gouvernent de nombreux aspects de la physiologie des hôtes. Les besoins de notre société en composés anti-microbiens sont très forts. Alternative potentielle aux antibiotiques, les inhibiteurs des messagers des interactions microbiennes en général, et du quorum sensing en particulier, semblent promis à de nombreuses applications médicales.
Glossaire :
- Archées: Lignée d’organismes unicellulaires, aux cellules dénuées de noyau ( cf. eucaryotes), qui se distinguent des bactéries par de nombreux caractères génétiques et cellulaires (ex : structure des membranes). Microorganismes souvent associés à des milieux extrêmes (anoxiques, fortes pressions, ..).
- Bactéries: Autre lignée d’organismes unicellulaires, aux cellules (dites ‘procaryotes’) dénués de noyau, bien distincte de celle des archées. [L’individuation de ces deux lignées, de même que celle des eucaryotes, datent de plusieurs milliards d’années]. Organismes les plus fréquents sur Terre, présents dans tous les milieux, dont les communautés microbiotiques. Ex : Echerichia coli, Pseudomonas sp., Vibrio sp., cyanobactéries, …
- Eucaryotes: Lignée d’organismes uni ou multicellulaires, aux cellules dotées d’un compartiment (dit ‘noyau’) logeant les chromosomes, délimité par une membrane. Exemples : Animaux, champignons, végétaux, algues.
- Protistes : Eucaryotes unicellulaires. Exemples : Paramécies, infusoires, algues unicellulaires (ex: algues rouges, vertes, glaucophytes), champignons unicellulaires.
- Symbiose : Association étroite et fonctionnelle entre deux espèces (ou plus), qui a évolué au bénéfice des différentes parties. Exemple : micorhizes racinaires (résultant de l’association fonctionnelle d’une plante et et d’un champignon), symbiose corallienne (association polype-algues unicellulaires), …
Bibliographie
Albuquerque P. & A. Casadevall, 2012. Quorum sensing in fungi – a review. Medical Mycology 50 : 337–345.
Chen X, Schauder S, Potier N, Van Dorsselaer A, Pelczer I, Bassler BL, Hughson FM (2002). Structural identification of a bacterial quorum-sensing signal containing boron. Nature 415(6871):545-549.
Choudhary S, Schmidt-Dannert C (2010). Applications of quorum sensing in biotechnology. Applied microbiology and biotechnology 86(5):1267-1279.
Defoirdt T, Boon N, Bossier P, Verstraete W (2004). Disruption of bacterial quorum sensing: an unexplored strategy to fight infections in aquaculture. Aquaculture 240(1):69-88.
Defoirdt T, Sorgeloos P, Bossier P (2011). Alternatives to antibiotics for the control of bacterial disease in aquaculture. Current opinion in microbiology 14(3):251-258.
Diggle S.B. et al., 2007a. Evolutionary theory of bacterial quorum sensing – When is a signal not a signal ? Phil. Trans. R. Soc. B 362 : 1241-1249.
Diggle S.P., Griffin A.S. et al., 2007b. Cooperation and conflict in quorum sensing bacterial populations. Nature 450 : 411-414.
Eberhard A, Burlingame AL, Eberhard C, Kenyon GL, Nealson KH, Oppenheimer NJ (1981). Structural identification of autoinducer of Photobacterium fischeri luciferase.
Biochemistry 20: 2444-2449.
Enders, G (2015). Le Charme discret de l’intestin: tout sur un organe mal aimé. Éditions Actes Sud.
Gram L, de Nys R, Maximilien R, Givskov, M, Steinberg P, Kjelleberg S (1996). Inhibitory effects of secondary metabolites from the red alga Delisea pulchra on swarming motility of Proteus mirabilis. Applied and Environmental Microbiology 62(11)4284-4287.
Hamilton, W. D. 1964. Genetical evolution of social behaviour I. J. Theor. Biol. 7 : 1–16.
Hmelo L, Van Mooy BAS (2009) Kinetic constraints on acylated homoserine lactone-based quorum sensing in marine environments. Aquat Microb Ecol 54 :127-133.
Hornby J.M., E.C. Jensen et al., 2001. Quorum sensing in the dimorphic Fungus Candida albicans is mediated by Farnesol. Appl. Environ. Microbiol. 67(7): 2982.
Krebbs J.R. & N.N. Davies (Eds), 1991, 1997. Behavioural Ecology. Oxford, Black Well Scientific Publications.
Marshall J., 2013. Quorum sensing. P.N.A.S. 110 (8) : 2690.
Maynard Smith J., 1989. Evolutionary Genetics. New York, Oxford University Press.
Maynard Smith J. & D. Harper, 2003. Animal signals. New York, Oxford University Press.
Miller MB & Bassler BL, 2001. Quorum sensing in bacteria. Annual Review of Microbiology 55: 165-169.
Nealson K, Platt T, Hastings JW (1970). The cellular control of the synthesis and activity of the bacterial luminescent system. Journal of Bacteriology 104 (1):313–22.
Oh HS, Yeon KM, Yang CS, Kim SR, Lee CH, Park SY et al. (2012). Control of membrane biofouling in MBR for wastewater treatment by quorum quenching bacteria encapsulated in microporous membrane. Environmental Science & Technology 46(9) : 4877-4884.
Popat R., Crusz S.A. et al., 2012. Quorum-sensing and cheating in bacterial biofilms. Proc. R. Soc. B 279 : 4765–4771.
Popat R., E.J.G. Politt et al., 2015. Conflict of interest ant signal interference lead to the breakdonwn of honest signal. Evolution, 69 (9) : 2371–2383.
Rasmussen TB, Manefield M, Andersen JB, Eberl L, Anthoni U, Christophersen C et al. (2000). How Delisea pulchra furanones affect quorum sensing and swarming motility in Serratia liquefaciens MG1. Microbiology 146(12)3237-3244.
Rolland JL, Stien D, Sanchez Ferandin S, Lami R (2016). Quorum sensing and quorum quenching in the phycopshere of phytoplankton : a case of chemical interaction in ecology. Journal of Chemical Ecology 42:1201-1211.
Sandoz KM, Mitzimberg SM &Schuster M (2007). Social cheating in Pseudomonas aeruginosa quorum sensing. Proceedings of the National Academy of Sciences 104(40):15876-15881.
Thompson JA, Oliveira RA, Djukovic A, Ubeda C, Xavier KB (2015). Manipulation of the quorum sensing signal AI-2 affects the antibiotic-treated gut microbiota. Cell reports 10(11): 1861-1871.
Teyssèdre A., 1993. La Communication animale, sur la scène de l’évolution. Paris, Nathan.
Teyssèdre A., 2006. Les clefs de la communication animale. Paris, Delachaux et Niestlé.
West S.A., A.S. Griffin, A. Gardner & S.P. Diggle, 2006. Social evolution theory for microbes. Nat. Rev. Microbiol. 4: 597–607.
West S.A., S.P. Diggle et al., 2007. The social live of microbes. Annu. Rev. Ecol. Evol. Syst. 38: 53–77.
Zhang F., 2012. Acyl homoserine lactone-based quorum sensing in a methanogenic archaeon. ISME Journal 6 : 1336–1344.
—
Article édité par Sébastien Barot.
Iconographie : A. Teyssèdre et R. Lami. Mise en ligne: A. Teyssèdre.
——

Un regard très… éclairant! J’ai appris plein de choses sur ce domaine de la recherche en pleine expansion, et un grand bravo pour la réflexion sur les implications évolutives…
Article présenté en termes très clairs et développé de façon très cohérente sur un domaine qui m’était tout à fait inconnu. Mon ignorance est telle que je ne savais même pas ce que signifie l’expression scientifique de « quorum sensing »!
Ma seule réserve, si je peux m’en permettre une, porte sur le vocabulaire qui, en certains cas, me paraît inutilement anthropomorphique. Des expressions telles que « langage bactérien » ou « dialogues moléculaires » ne sont-elles pas de pures métaphores? Quel avantage y a-t-il à parler des activités « sociales » de protistes, plutôt que de leurs activités collectives, coopératives ou de leurs « comportements holistiques » ?
Merci à Jean-François et à Bernard pour leurs commentaires élogieux! Merci aussi à Bernard pour sa question sur l’anthropomorphisme de certaines expressions utilisées dans le texte. Personnellement, j’aurais deux réponses, différant selon les termes considérés.
Les expressions « dialogues moléculaires » et « langage bactérien » font clairement un parallèle avec les dialogues et le langage humains. Mais plus que des métaphores, je dirais que ce sont des analogies, tout comme on parle aujourd’hui de dialogue ‘homme-machine’ entre un humain et son ordinateur, ou de ‘langage des plantes’ à propos des motifs colorés et parfums des fleurs (émis ‘à l’intention’ de leurs pollinisateurs), ou de leurs phéromones d’alarme.
Dans cet article, nous aurions pu définir de façon plus générale (« suprahumaine ») le terme dialogue comme un échange d’information, ou de ‘messages’, entre deux ou plusieurs individus. [Chez les bactéries, il ne s’agit pas comme chez les humains d’échanges d’idées, d’opinions, .. mais de signaux chimiques véhiculant cette information.]
Quant au ‘langage’ d’une espèce, il pourrait être défini ici de façon plus générale comme le système de codage des informations émises sous forme de stimuli (chimiques, visuels, sonores..), au service de diverses fonctions de communication, par les membres de cette espèce. [A la différence du langage humain, celui des bactéries n’est ni combinatoire(!) ni appris au début de la vie, mais hérité avec le bagage génétique, et évolue sous la pression de la sélection naturelle.]
Pour le deuxième type de termes, je posterai demain une autre réponse..
Bonjour,
(Suite de ma réponse à Bernard.) Si les termes de ‘langage’ et surtout de ‘dialogues’, appliqués aux bactéries, peuvent être jugés anthropomorphiques, ce n’est plus le cas je pense du qualificatif de ‘social’. Celui-ci est en effet couramment utilisé depuis des décennies par les éthologues et écologues qui explorent le comportement d’espèces vivant en groupes (dits ‘sociaux’) plus ou moins nombreux et organisés, pour qualifier les interactions entre les membres de ces groupes, ou entre membres de groupes différents.
Plus encore: bien qu’utilisé surtout en sciences humaines et en éthologie, le terme ‘social’ n’est a priori pas réservé aux seuls animaux (dont humains). Il devrait pouvoir s’appliquer à toutes les interactions et comportements stimulés par l’activité de congénères et orchestrés par des signaux de communication, chez l’ensemble des êtres vivants – y compris chez les bactéries et autres microorganismes adeptes du quorum sensing..
Je comprends très bien les arguments avancés en faveur d’un usage extensif des termes « dialogue », « langage » et « social » appliqués à des bactéries; mais je persiste à penser que cet usage est dangereux et qu’il vaudrait mieux l’éviter lorsqu’il risque d’entraîner des confusions.
Un petit commentaire de parasitologue/protistologue : la composante eucaryote du microbiote ne se limite pas aux champignons unicellulaires; elle comporte aussi une diversité de protistes (Blastocystis, Giardia, Entamoeba, diverses coccidies,…). Bien qu’actuellement moins étudiés, ne les oublions pas !
https://www.frontiersin.org/articles/10.3389/fmicb.2014.00298/full
Bonjour,
et merci pour votre remarque. La diversité des protistes intestinaux est importante elle aussi!