La Société Française d’Ecologie (SFE) vous propose ce regard de Tatiana Giraud, Directrice de recherches CNRS, et de Sylvain Billiard, Maître de conférences à l’Université de Lille, sur l’évolution de la reproduction sexuée.
MERCI DE PARTICIPER à ces regards et débats sur la biodiversité en postant vos commentaires et questions sur les forums de discussion qui suivent les articles; les auteurs vous répondront.
———-
Pourquoi existe-t-il des sexes différents ?
Et pourquoi souvent seulement deux ?
Tatiana Giraud1 et Sylvain Billiard2
1 Directrice de Recherches CNRS, chargée de cours à l’école Polytechnique, Directrice adjointe de l’UMR 8079, Ecologie, Systématique et Evolution, CNRS, Université Paris Sud, AgroParisTech, Université Paris Saclay. Prix SFE2 de la recherche en 2018.
2 Maître de conférences, Université de Lille, Laboratoire Evo-Eco-Paléo, UMR 8198.
Article édité par Anne Teyssèdre
——-
Mots clés : Reproduction sexuée, évolution, eucaryotes, anisogamie, populations, selection naturelle, autofécondation, allofécondation, mitochondries, types sexuels, champignons.
——–
- Pourquoi existe-t-il des fonctions mâles et femelles?
- Comment utiliser au mieux ses ressources ? Sélection sur l’investissement parental
- Avec qui faire du sexe ? Une sélection pour l’allofécondation
- Avec qui faire du sexe ? Un moyen de gérer les conflits génétiques
- Pourquoi seulement deux sexes le plus souvent ?
- Conclusion
- Glossaire
- Bibliographie
- Forum de discussion sur ce regard
——-
Pourquoi existe-t-il des fonctions mâles et femelles?
Pourquoi existe-t-il des individus morphologiquement différenciés en mâles et femelles chez la plupart des animaux, ainsi que chez de nombreuses plantes et algues ? Plus largement, pourquoi la reproduction sexuée implique-t-elle généralement la fusion de deux types de gamètes* morphologiquement bien différenciés – un gros ovule « femelle » et un minuscule spermatozoïde « mâle »?
Ces questions peuvent paraître surprenantes, tant nous sommes habitués à l’idée que la reproduction « sexuée » implique l’accouplement d’un mâle et d’une femelle chez les animaux, ou la fusion d’un grain de pollen et d’un ovule chez les plantes. Cependant, tout comme l’existence même de la reproduction sexuée, qui pose aussi question mais a été plus étudiée (Otto & Lenormand 2001 ; Gouyon & Giraud 2009 a et b), cet état de fait mérite une explication évolutive : comment la sélection naturelle a-t-elle pu favoriser des individus qui mettent beaucoup d’énergie et de ressources pour la production de gros gamètes (ovules), et laissent fusionner leurs « coûteuses » cellules reproductrices avec de petits gamètes (spermatozoïdes) n’apportant pas, ou très peu, de ressources énergétiques ou nutritives aux embryons ?
Une telle situation, avec différenciation des cellules reproductrices en deux tailles contrastées, est appelée « anisogamie »*. C’est la règle chez de nombreux organismes eucaryotes* multicellulaires – dont l’ensemble des animaux et végétaux.
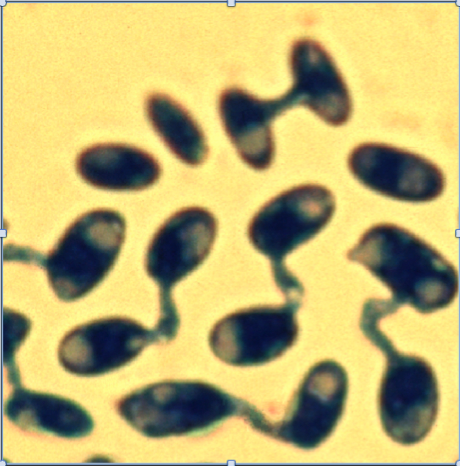
Figure 1 : Conjugaison entre gamètes chez le champignon Microbotryum. Il s’agit d’une espèce isogame : tous les gamètes* ont la même taille. Les croisements ne peuvent cependant se produire qu’entre gamètes de « types sexuels » différents (Photo Michael Hood).
Tous les eucaryotes, cependant, ne sont pas « anisogames » : chez certaines espèces d’algues ou de champignons, tous les gamètes sont de même taille (Figure 1), une situation appelée « isogamie* », qui est sans doute ancestrale.
La question devient alors : dans quelles conditions l’isogamie peut-elle évoluer vers une différenciation en deux tailles contrastées de gamètes dans la population? La biologie évolutive peut nous permettre de répondre à cette question, en explorant les avantages de l’anisogamie* en termes de sélection naturelle : en quoi l’évolution vers la production de petits ou de gros gamètes – à partir de gamètes de taille intermédiaire- pourrait-elle conférer une meilleure valeur sélective*, c’est-à-dire permettre aux gènes contrôlant ces caractères d’être mieux transmis aux générations suivantes que les « stratégies » alternatives?
Comment utiliser au mieux ses ressources ? Sélection sur l’investissement parental
A partir d’une situation ancestrale d’isogamie*, il est facile d’imaginer pourquoi la production de plus petits gamètes* pourrait être sélectionnée si mettre moins de ressources dans chaque gamète permet d’en produire plus : émettre plus de gamètes devrait évidemment permettre de laisser plus de descendants. De tels gamètes « mâles » parasiteraient en quelque sorte les plus gros gamètes dans la population. Mais il est plus difficile de comprendre, dans ces conditions, pourquoi les individus produisant les gros gamètes persisteraient dans les populations, voire pourquoi des individus produisant des gamètes encore plus gros, encore plus gorgés de ressources, pourraient être avantagés, menant au type « femelle ».
Mais si les zygotes* (nouveaux individus diploïdes) issus de la fusion des gamètes sont d’autant plus viables qu’ils ont une grande quantité de réserves, il peut effectivement être avantageux pour certains individus de produire des gamètes encore plus gros (cf. Figure 2). Un individu produisant des gamètes de taille intermédiaire aura en effet le double désavantage de produire moins de gamètes que les proto-mâles, et des zygotes moins viables que les proto-femelles (Parker et al. 1972). Les individus produisant des petits gamètes auront toujours l’avantage d’en émettre plus, mais ils ne peuvent pas envahir complètement la population, car ils ne peuvent laisser des descendants viables qu’en fécondant des gros gamètes : s’ils deviennent trop fréquents, les petits gamètes seront désavantagés, car ils ne trouveront que des petits gamètes avec lesquels s’apparier.
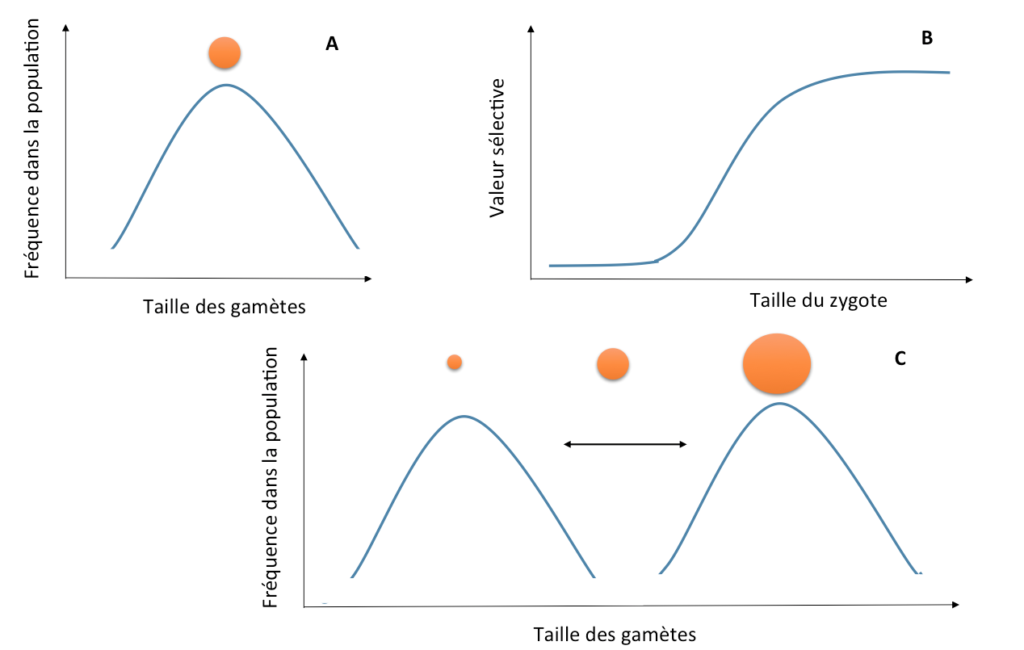
Figure 2 : Evolution de gamètes* mâles et femelles (C) à partir d’une situation d’isogamie (une seule taille de gamètes, A). Des modèles mathématiques montrent que cela est possible si la valeur sélective* des zygotes*, en fonction de leur taille, a une forme sigmoïde marquée (B).
Dans une situation où de nombreux petits gamètes sont présents, les gros gamètes peuvent donc être tout de même avantagés car ils sont toujours assurés de laisser assez de ressources à leurs descendants pour qu’ils puissent se développer, contrairement aux petits gamètes (Figure 2). Mais un mystère reste entier : pourquoi les gros gamètes ne peuvent-ils pas fusionner entre eux plutôt que de se faire systématiquement « parasiter » par un petit gamète qui n’apporte aucune énergie aux descendants ? Des modèles mathématiques montrent que l’anisogamie* ne peut évoluer, à partir d’une situation où tous les gamètes sont de même taille, que si des « types sexuels » génétiques préexistent dans cette population ; c’est-à-dire s’il préexiste plusieurs types de gamètes, initialement de même taille mais différant à un gène donné, et ne pouvant s’apparier qu’entre types différents. A partir de cette différenciation (génétique) initiale, les types sexuels pourraient alors se spécialiser (morphologiquement) en mâles et femelles au fil des générations (Parker et al. 1972 ; Ferris et al. 2010).
Avec qui faire du sexe ? Une sélection pour l’allofécondation
Il reste maintenant à comprendre pourquoi des types sexuels peuvent évoluer. De nombreuses espèces de plantes, d’algues et de champignons présentent différents « types sexuels ». Ce type de système empêche l’autofécondation chez de nombreuses espèces de plantes hermaphrodites, ce sont les systèmes d’auto-incompatibilité, qui ont vraisemblablement évolué pour éviter la dépression de consanguinité. Effectivement, les croisements par autofécondation révèlent souvent des mutations désavantageuses et donnent alors des descendants peu viables.
Chez les champignons, les types sexuels n’empêchent pas l’autofécondation des individus diploïdes*, mais empêchent les croisements entre lignées clonales haploïdes* (Figure 3) (Billiard et al. 2011, 2012). Des croisements entre clones haploïdes identiques ne permettraient pas de bénéficier des avantages de la recombinaison, ne créant aucune variabilité génétique, tout en induisant la plupart des coûts de la reproduction sexuée (Lopez-Villavicencio et al., 2013). Les types sexuels chez les champignons auraient donc évolué pour empêcher les croisements entre clones, les lignées clonales étant fréquentes chez ces organismes. De façon générale, donc, une explication évolutive pour expliquer l’existence de types sexuels serait qu’ils permettent de favoriser des fécondations entre individus différents (Charlesworth & Charlesworth, 1979), entre lignées haploïdes ou diploïdes différentes suivant les règnes.
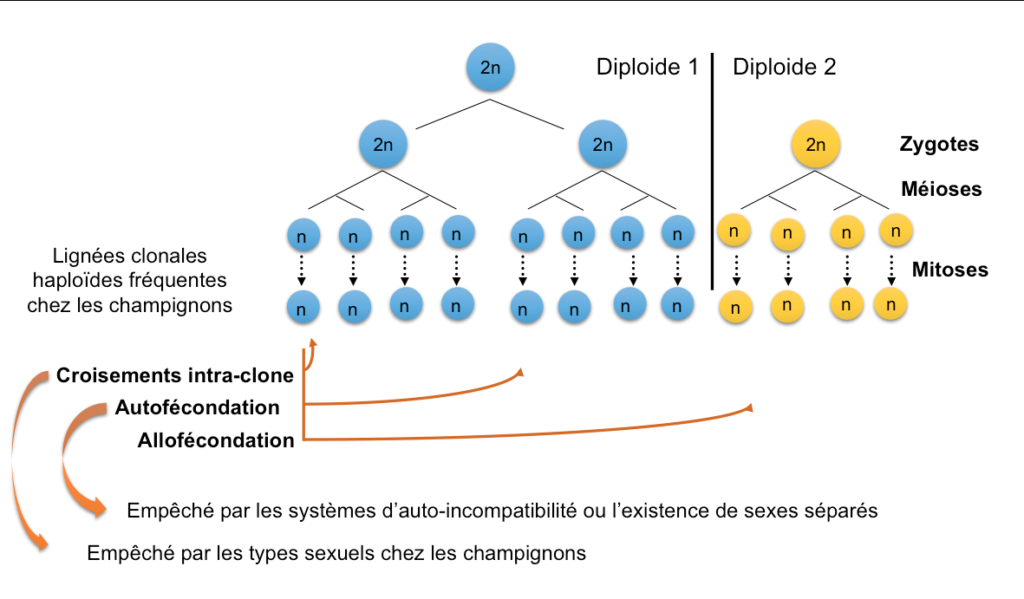
Figure 3 : Illustration des différents types de fécondations possibles : 1) intra-clone, entre haploïdes génétiquement identiques, 2) autofécondation, entre gamètes différents issus d’un même individu diploïde, 3) allofécondation, entre gamètes issus de différents individus diploïdes. L’autofécondation est empêchée par les systèmes d’auto-incompatibilité ou l’existence de sexes séparés. Les croisements intra-clones sont empêchés par les types sexuels chez les champignons.
Avec qui faire du sexe ? Un moyen de gérer les conflits génétiques
Une autre hypothèse évolutive pour expliquer l’existence de types sexuels ou de sexes différents, de prime abord assez surprenante, est liée à la transmission des mitochondries, ces petits organites logés au sein des cellules et qui leur sont nécessaires pour produire de l’énergie. Il existe de nombreuses mitochondries par cellule, il peut donc exister une compétition entre elles : celle qui se répliquera le plus rapidement envahira l’organisme et aura plus de chances d’être transmise à la génération suivante (Figure 4A). Cela se produira même aux dépends de l’organisme qui la porte: si une mitochondrie produit moins d’énergie pour la cellule mais que cela lui permet de se répliquer plus vite, elle sera avantagée par rapport aux autres en étant transmise plus fréquemment. Ce scénario correspond bien à l’existence de mutants connus chez certaines mitochondries, qui se répliquent plus vite mais sont moins efficaces en termes de production d’énergie (Hintz, Anderson & Horgen, 1988; Taylor, Zeyl & Cooke, 2002).
Une telle situation serait évidemment désavantageuse pour l’organisme dans son ensemble, qui se retrouverait avec des mitochondries peu efficaces. Une hypothèse avancée a été que les sexes différents auraient évolué pour permettre la transmission des mitochondries par un seul parent (Hurst et Hamilton 1992). De fait, les mitochondries sont le plus souvent transmises uniquement par la mère, et exceptionnellement uniquement par le père, comme chez certaines plantes ou champignons (Reboud & Zeyl, 1994 ; Borkhardt & Olson, 1983).
Cette hérédité uniparentale empêche effectivement l’évolution de mitochondries moins efficaces car le destin des mitochondries devient lié à celui de l’organisme qui les porte : une lignée de mitochondries moins efficace diminuera le nombre de descendants de l’organisme qui l’héberge, et donc le nombre de ses propres descendants (Figure 4B). La lignée de mitochondries moins efficaces ne peut plus contrebalancer sa moindre efficacité énergétique par une plus grande capacité de réplication et donc de transmission dans les descendants : une seule lignée de mitochondries est de toutes façons transmise dans les descendants dans la situation d’hérédité uni-parentale et son destin est lié à celui du génome nucléaire.
S’il apparaît donc effectivement avantageux pour le génome nucléaire de forcer une hérédité uniparentale des mitochondries, et si les mitochondries sont effectivement le plus souvent transmises par un des sexes ou un des types sexuels (Barr et al. 2005; Wilch et al., 1992; Yan & Xu, 2003 ; Sato et al. 2017), il apparaît en fait que cette liaison n’est pas parfaite : certains champignons par exemple possèdent d’autres mécanismes permettant une hérédité uniparentale des mitochondries, tout en produisant tout de même des gamètes mâles et femelles (tous équipés de mitochondries) (Billiard et al. 2011, 2012). Sans doute l’hérédité des mitochondries s’est-elle plutôt greffée sur un système préexistant de sexes ou types sexuels différenciés, des types sexuels ayant évolué en premier lieu pour favoriser l’allofécondation et des sexes différents ayant évolué secondairement par une sélection sur l’investissement des ressources (Hadjivasiliou et al. 2013).
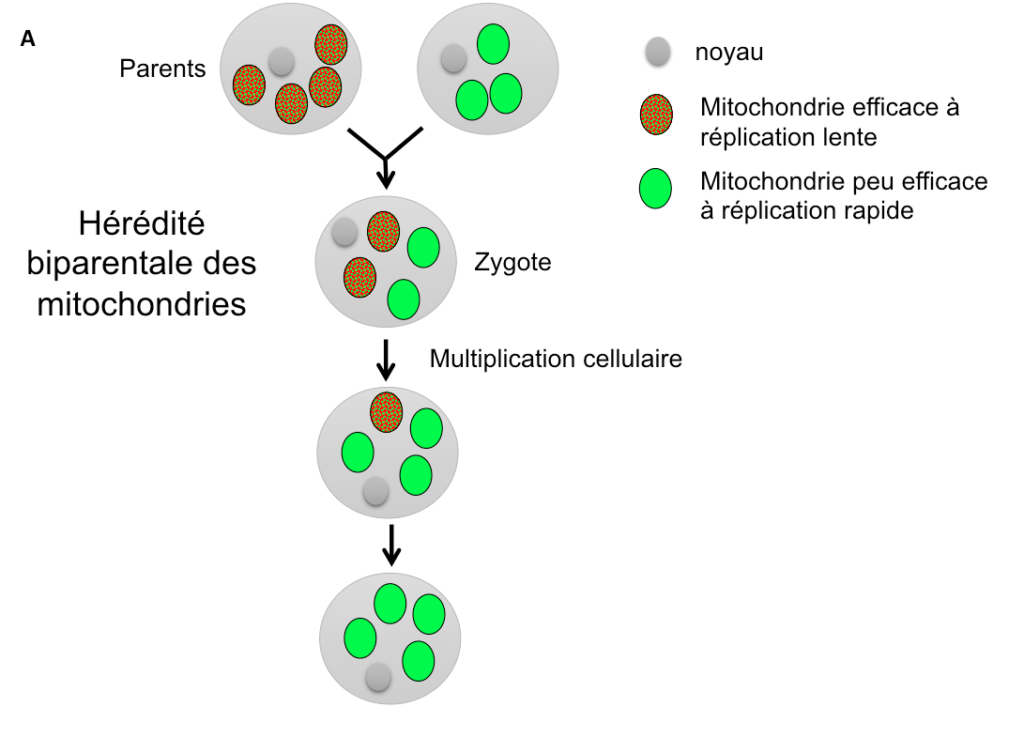
Figure 4A
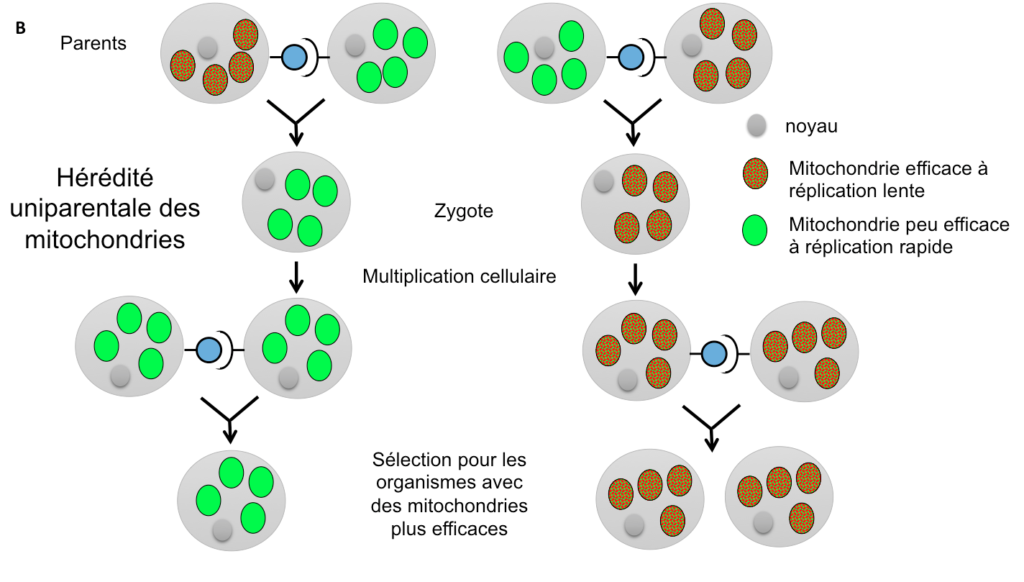
Figure 4B
Figure 4 (A et B): Situations comparées d’hérédité biparentale (A) ou uniparentale (B) des mitochondries. Dans le cas d’une hérédité biparentale, les mitochondries se répliquant plus vite augmentent en fréquence dans les populations, même si elles sont moins efficaces en termes de production d’énergie pour la cellule. Dans le cas d’une hérédité uniparentale, les mitochondries les plus efficaces sont sélectionnées à travers la sélection sur les organismes portant leur haplotype, car il n’y a plus de compétition intra-cellulaire pour une réplication plus rapide.
Pourquoi seulement deux sexes le plus souvent ?
Au-delà de l’existence des sexes et des types sexuels, une autre question intéressante et de nouveau a priori surprenante est celle-ci : pourquoi existe-t-il le plus souvent seulement 2 sexes ou deux types sexuels ? Il s’agit de la situation la plus fréquente et pourtant la plus désavantageuse : avec 2 sexes ou 2 types sexuels, chaque gamète est incompatible avec la moitié de la population. Tout nouveau sexe ou type sexuel (qui serait par définition compatible avec les 2 sexes ou types sexuels existants mais incompatible avec lui-même) aura un énorme avantage, en étant compatible avec tous les autres individus de la population, et augmentera en fréquence dans la population.
Il devrait donc y avoir de nombreux sexes ou types sexuels dans les populations. Nous sommes tellement habitués à notre déterminisme du sexe humain avec des chromosomes sexuels X et Y et à la forte différenciation phénotypique en mâles et femelles, que nous avons du mal à seulement imaginer la possibilité d’un 3ème sexe. Pourtant il n’existe aucune impossibilité a priori, et même, il existe des organismes avec des dizaines, voire des milliers de types sexuels.
Chez les champignons poussant dans nos sous-bois par exemple, et dont nous nous régalons tous les automnes (Figure 5), cette situation est fréquente : il existe des milliers de types sexuels différents (Casselton & Kues, 2007), chacun étant compatible avec tous les autres. De même, il existe des dizaines d’allèles aux systèmes d’auto-incompatibilité chez les plantes (hermaphrodites), qui constituent des types sexuels (Vekemans et al. 2004), et il existe des organismes unicellulaires qui possèdent une dizaine de types sexuels différents (Moriyama & Kawano, 2003 ; Dini & Luporini 1979). Pourtant, même chez les champignons, la plupart des espèces ne possèdent que deux types sexuels.
L’explication du maintien de seulement deux sexes ou deux types sexuels pourrait résider dans nos hypothèses précédentes : si l’hérédité des mitochondries est liée à un sexe ou à un type sexuel, comme c’est le cas chez les plantes et les animaux, et beaucoup de champignons, alors l’émergence d’un 3ème sexe ou d’un 3ème type sexuel peut être compliquée : comment gérer la transmission uniparentale des mitochondries quand il existe de nombreux types de parents possibles ? Qui va l’emporter sur les autres ? Si c’est simple avec 2 sexes (la mère transmet toujours les mitochondries, et jamais le père, qui de toutes façons, ne met pas beaucoup de cytoplasme dans ses spermatozoïdes), cela devient difficilement gérable avec des dizaines de types sexuels (Hurst 1996).
Certaines amibes ont mis en place un système de hiérarchie entre une dizaine de types sexuels différents pour la transmission des mitochondries (Moriyama & Kawano, 2003) mais ce type de cas reste exceptionnel. Bien d’autres hypothèses ont été proposées pour expliquer le maintien de seulement deux types sexuels dans les populations, comme par exemple l’asymétrie dans les molécules de reconnaissance entre gamètes de types différents (Hoekstra 1982, Hadjivasiliou & Pomiankowski 2016), et le brouillard n’est pas encore tout à fait levé.

Photo de Suillus brevipes (© Michael Wood). Champignon homobasidiomycète, un groupe dans lequel les espèces possèdent de nombreux types sexuels, parfois des milliers.
Conclusion
En conclusion, les fonctions mâles et femelles sont certainement le résultat d’une sélection disruptive* sur la taille des gamètes, favorisant d’une part la production de petits gamètes qui peuvent ainsi être plus nombreux, et d’autre part celle de gros gamètes assurant une taille minimale viable pour les embryons. Les types sexuels ont quant à eux très probablement évolué pour éviter l’autofécondation. L’hérédité uni-parentale des mitochondries, enfin, a probablement évolué en se greffant sur ces systèmes préexistants, limitant ensuite le nombre de sexes ou de types sexuels. Plus généralement, la biologie évolutive permet ainsi d’expliquer le vivant de façon unique et captivante.
Glossaire
- Anisogamie : Coexistence de deux ou plusieurs types morphologiques de gamètes* (de tailles différentes) dans une population.
- Diploïde : Une cellule est diploïde lorsque les chromosomes qu’elle contient sont chacun en deux exemplaires.
- Eucaryote : organisme caractérisé par la présence, dans chaque cellule, d’un noyau protégeant le matériel génétique et généralement de mitochondries*.
- Gamète : cellule reproductrice haploïde* spécialisée dans la fécondation (par exemple spermatozoïde et ovule).
- Haploïde : Une cellule est haploïde lorsque les chromosomes qu’elle contient sont chacun en un seul exemplaire. Le concept est généralement l’opposé de diploïde*, terme désignant les cellules avec des chromosomes en double exemplaire (2n chromosomes).
- Isogamie : Existence d’un seul type morphologique de gamètes*, sans fonction mâle ni femelle, dans une population.
- Mitochondries : organites présent dans les cellules eucaryotes*, produisant de l’énergie par la chaîne respiratoire. Dotées de leur propre ADN, les mitochondries se reproduisent indépendamment de leur hôte cellulaire. [Les mitochondries descendent en effet de bactéries libres qui ont établi une symbiose avec un ancêtre unicellulaire des eucaryotes* actuels.]
- Sélection disruptive : Sélection naturelle favorisant des morphologies (ou phénotypes) extrêmes dans une population, et défavorisant les phénotypes intermédiaires.
- Valeur sélective : dans le processus de sélection naturelle, mesure de l’avantage relatif en termes de nombre de copies de matériel génétique transmises à la génération suivante. Cette mesure prend en compte par exemple le nombre de descendants viables et fertiles produits en moyenne à la génération suivante.
- Zygote : cellule diploïde issue de la fusion de deux gamètes haploïdes, à l’origine d’un individu de la génération suivante.
Bibliographie
Barr, C., M. Neiman & D. Taylor. 2005. Inheritance and recombination of mitochondrial genomes in plants, fungi and animals. New Phytologist 168, 39–50.
Billiard S., M. Lopez-Villavicencio, B. Devier, M.E. Hood, C. Fairhead, & T. Giraud. 2011. Having sex, yes, but with whom? Inferences from fungi on the evolution of anisogamy and mating types. Biological Reviews. 86, 421–442.
Billiard S., M. Lopez-Villavicencio, M.E. Hood & T. Giraud. 2012. Sex, outcrossing and mating types – Unsolved questions in fungi and in general. J Evol Biol 25(6):1020-1038.
Borkhardt, B. & L. W. Olson. 1983. Paternal inheritance of the mitochondrial-DNA in interspecific crosses of the aquatic fungus Allomyces. Current Genetics 7,403–404.
Casselton, L. A. & U. Kues 2007. The origin of multiple mating types in the model mushrooms Coprinopsis cinerea and Schizophyllum commune. In Sex in fungi: molecular determination and evolutionary implications (ed. J. Heitman, J.W. Kronstad, J. W. Taylor and L. A. Casselton) Washington, DC: ASM Press. pp. 142–147.
Charlesworth, D. & B. Charlesworth. 1979. The evolution and breakdown of S-allele systems. Heredity 43, 41–55.
Dini, F. Luporini P. 1979. The multiple mating type system of the marine ciliate Euplotes crassus (Dujardin) Archiv für Protistenkunde. 121: 238-245.
Ferris P., B. J. S. C. Olson, et al. 2010. Evolution of an expanded sex-determining locus in Volvox. Science 328, 351-354.
Gouyon P.H. & T. Giraud. 2009. Tout est-il vraiment pour le mieux dans le meilleur des mondes sexués ? In : Aux Origines de la Sexualité. Ed. Pierre-Henri Gouyon. Editions Fayard.
Gouyon P.H. & T. Giraud T. 2009. Le sexe et l’évolution. In : Les mondes darwiniens, Les sciences de l’évolution aujourd’hui. Ed. Thomas Heams, Philippe Huneman, Guillaume Lecointre, Marc Silberstein. Editions Syllepse.
Hadjivasiliou Z., Lane N., Seymour R.M. & Pomiankowski A. 2013. Dynamics of mitochondrial inheritance in the evolution of binary mating types and two sexes. Proc Soc R London B 280: 20131920
Hadjivasiliou Z. & Pomiankowski A. 2016 Gamete signalling underlies the evolution of mating types and their number Philos Trans R Soc Lond B 371: 20150531.
Hintz,W. E. A., J. B. Anderson & P. Horgen, 1988. Nuclear migration and mitochondrial inheritance in the mushroom Agaricus bitorquis. Genetics 119: 35–41.
Hoekstra R. F. 1982 On the asymmetry of sex:- evolution of mating types in isogamous populations. J. Theor. Biol. 98, 427–451.
Hurst, L. D. 1996. « Why are there only two sexes? » Proc R Soc Lond B 263: 415-422.
Hurst, L. 1992. Cyoplasmic fusion and the nature of sexes. Proc Soc R London B 247: 189-194.
López-Villavicencio M., S. Schoustra, T. Giraud, & A.J.M. Debets. 2013. Evidence for deleterious effects of recombination and advantages of sex independent of recombination using fungal models J Evol Biol 26:1968-78.
Moriyama, Y. & S. Kawano. 2003. Rapid, selective digestion of mitochondrial DNA in accordance with the matA hierarchy of multiallelic mating types in the mitochondrial inheritance of Physarum polycephalum. Genetics 164, 963–975.
Otto, S. P., & T. Lenormand. 2002. Resolving the paradox of sex and recombination. 3:252-261.
Parker, G. A., R. R. Baker & V. G. F. Smith. 1972. The origin and evolution of gamete dimorphism and the male-female phenomenon. Journal of Theoretical Biology 36, 181–198.
Reboud, X. & C. Zeyl. 1994. Organelle inheritance in plants. Heredity 72, 132–140.
Sato, Ken & Sato. 2017. Multiple ways to prevent transmission of paternal mitochondrial DNA for maternal inheritance in animals. Journal of Biochemistry 162, 247-253.
Taylor, D., C. Zeyl & E. Cooke. 2002. Conflicting levels of selection in the accumulation of mitochondrial defects in Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences U.S.A. 99, 3690–3694.
Vekemans, X., C. Poux, P. M. Goubet, V. Castric. 2014 The evolution of selfing from outcrossing ancestors in Brassicaceae: what have we learned from variation at the S-locus? Journal of Evolutionary Biology 2: 1372-1385.
Yan, Z. & J. Xu. 2003. Mitochondria are inherited from the MATa parent in crosses of the basidiomycete fungus Cryptococcus neoformans. Genetics 163, 1315–1325.
Wilch, G., S. Ward & A. Castle. 1992. Transmission of mitochondrial DNA in Ustilago violacea. Current genetics 22, 135–140.
Article édité et mis en ligne par Anne Teyssèdre.
——


Merci pour cet article.
Au delà de la question « pourquoi souvent deux sexes ? » je me suis toujours demandé pourquoi, le plus souvent (toujours?), deux individus?
Je me dis que ceci peut être expliqué par la difficulté de réunir plusieurs individus pour la reproduction. Deux individus doit être compliqué mais suffisamment rentable au niveau brassage génétique. Peut être que réunir/synchroniser trois individus par exemple devient beaucoup trop compliqué ou coûteux en énergie pour que ce soit avantageux.
Voilà, au fond c’est une question de seuil de rentabilité découlant de l’avantage que cela procure (brassage) par rapport à son coût.
Les auteurs ont ils un avis à ce sujet?
Effectivement, gérer un brassage génétique équitable avec trois individus représente certainement des coûts et une complexité trop importanct pour les bénéfices que cela pourrait apporter. Tout d’abord, les femelles (ou fonctions femelles) peuvent souffrir d’un effet Allee, c’est-à-dire que certains ovules produits ne sont pas fertilisés par manque de partenaire sexuels : il n’y a pas assez de gamètes mâles disponibles dans l’environnement, ce qui implique une perte de ressources importantes pour les femelles. Ce serait sans doute encore pire si 3 individus étaient nécessaires pour se reproduire. Il faudrait également des systèmes qui redistribuent de façon égale les gènes des trois parents (sinon le phénomène peut mener à des « tricheurs » comme les mitochondries mutantes dont nous parlons dans l’article), et il faudrait un système de transmission uniparentale des mitochondries, comme nous expliquons également ci-dessus.
D’autre part, les bénéfices ne seraient certainement pas très élevés. En effet, les modèles mathématiques et expériences ont déjà du mal à mettre en évidence des avantages significatifs à court terme pour une femelle d’enlever la moitié de ses gènes pour produire ses descendants dans lesquels elle est la seule à mettre des ressources dans la plupart des espèces, alors enlever 2/3 de ses gènes semblerait encore plus désavantageux. Produire des descendants génétiquement différents d’elle-même n’apporte en effet pas de grands bénéfices dans de nombreuses situations (Cf les articles cités au-dessus, Gouyon P.H. & T. Giraud. 2009).
D’ailleurs, de multiples mécanismes ont évolué qui empêchent la fécondation d’un ovule par de multiples gamètes males chez les animaux et chez les plantes. Cependant, il est à noter que cela arrive tout de même exceptionnellement, et que cela pourrait donner naissance à de nouvelles espèces par polyploïdisation (Dresselhaus & Johnson 2018, Current Biology). Dans certaines circonstances écologiques, le brassage génétique entre trois individus pourrait donc se produire et être avantageux, et être évolutivement important sur de très larges échelles de temps. Mais les bénéfices ne sont sans doute pas suffisamment fréquents pour que soient mis en place des systèmes de reproduction nécessitant obligatoirement trois partenaires sexuels, à l’échelle d’une population ou d’une espèce, donc sur des courtes échelles de temps.