La Société Française d’Ecologie et d’Evolution (SFE2) vous propose ce regard de Soizig Le Stradic et Elise Buisson, jeunes chercheuses en écologie respectivement à l’Université Technique de Munich et à l’IMBE, sur la préservation et la restauration des savanes.
MERCI DE PARTICIPER à ces regards et débats sur la biodiversité en postant vos commentaires et questions sur les forums de discussion qui suivent les articles; les auteurs vous répondront.
———-
Restaurer les écosystèmes tropicaux :
et si tout ne se résumait pas à planter des arbres ?
Soizig Le Stradic(1) et Elise Buisson(2),
(1) : Chercheuse post-doctorante au Technische Universität München, Chair of Restoration Ecolog, Ecology and Ecosystem Management Department, 85354 Freising, Allemagne
(2) : Institut Méditerranéen de Biodiversité et d’Ecologie marine et continentale (IMBE), Avignon Université, 84911 Avignon, France
Article édité par Anne Teyssèdre
——-
Mots clés : Afforestation, pelouses tropicales, savanes, biodiversité, feu, résilience,
restauration écologique.
——–
- Les écosystèmes herbacés primaires tropicaux
- Le feu, un acteur majeur de la savane
- Biodiversité et problèmes de conservation
- La résilience des savanes
- Restauration des écosystèmes herbacés tropicaux
- Afforestation
- Conclusion
- Glossaire
- Remerciements
- Bibliographie
- Pour en savoir plus
- Forum de discussion sur ce regard
——-
Les écosystèmes herbacés primaires tropicaux
A l’instar des forêts primaires tropicales et équatoriales (ou forêts anciennes, voir Ecosystème primaire* dans le glossaire), les écosystèmes herbacés primaires ou anciens* (Old-growth grasslands –OGGs – en anglais) dans lesquels on peut regrouper les savanes et les pelouses tropicales et subtropicales, sont des écosystèmes extrêmement riches en espèces, qui ont nécessité des siècles pour s’assembler (Parr et al. 2014; Veldman et al. 2015a). Les écosystèmes herbacés se retrouvent de l’Equateur aux zones arctiques. Ce regard concerne plus particulièrement les écosystèmes herbacés anciens* de la zone intertropicale, nommés « savanes » dans le reste du texte. Très diversifiées, celles-ci couvrent environ 20 % de la surface terrestre (Scholes et Archer 1997; Parr et al. 2014).
Ces savanes présentent des physionomies très variables, pouvant être très ouvertes ou assez fermées (selon la proportion du couvert arboré). La caractéristique commune définissant ces écosystèmes est la présence d’une strate herbacée continue, composée essentiellement de graminées en C4* (dotées d’un type de photosynthèse* adapté au milieux arides, cf. glossaire) et d’espèces herbacées non ligneuses (dites forbs*). Cette strate herbacée particulièrement riche en espèces est essentielle au fonctionnement de ces écosystèmes (Parr et al. 2014; Veldman et al. 2015a).

Fig.1 : Les ‘campos rupestres’ du Parc National de la Serra do Cipό (Brésil), un exemple d’écosystème herbacé primaire (Photo : S. Le Stradic)
La coexistence de ces deux formes de vie principale, à savoir les espèces arborées et les espèces herbacées, est assez inhabituelle et a suscité la curiosité des chercheurs depuis de nombreuses années. Alors que les arbres sont résistants* ou résilients* au feu, les espèces composant la strate herbacée sont, elles, intolérantes à l’ombre (Pausas et Bond 2020). De nombreuses études ont mis en évidence que c’est l’interaction de plusieurs processus en relation avec l’utilisation de l’eau, les propriétés du sol et les régimes de perturbations* comme le feu qui est à l’origine de cette coexistence (Hoffmann 1998; Sankaran et al. 2005; February et Higgins 2010; Silva et Batalha 2011; Rossatto et al. 2014).
Traditionnellement, la distribution des différents types de végétation, appelés biomes*, est attribuée au climat et aux propriétés du sol. Les régions tropicales sont marquées par une forte saisonnalité avec l’alternance d’une saison sèche et d’une saison humide. Le climat (la quantité de précipitations et la durée de la saison des pluies entre autres) est de fait un facteur déterminant de la structure des végétations de savanes, influençant notamment la présence de la couverture arborée (Sankaran et al. 2005; Lehmann et al. 2014). Cependant sous les tropiques de nombreuses zones où l’on pourrait s’attendre à observer des forêts, du fait de la quantité de précipitations, sont occupées par des écosystème ouverts : les savanes (Staver et al. 2011; Dantas et al. 2016; Pausas et Bond 2020).
Le feu, un acteur majeur de la savane
La distribution des savanes ne peut être prédite uniquement par le climat. Ainsi, des perturbations telles que l’herbivorie (celle notamment des « méga-herbivores », tels qu’éléphants et ongulés) et le feu jouent un rôle écologique et évolutif prépondérant pour les savanes (Pausas et Bond 2020). Ces perturbations favorisent l’occurrence des graminées et en limitant la couverture ligneuse, en particulier pour les savanes humides où les précipitations pourraient permettre la présence de forêts (Staver et al. 2011; Lehmann et al. 2014; Pausas et Bond 2020).
La présence des graminées en C4* alimente une boucle de rétroaction représentant le biocombustible majeur et favorisant les feux ; ces plantes sont essentielles aux différents processus écologiques et aux interactions. Certaines études ont souligné que les caractéristiques du sol (facteurs édaphiques), telles que sa fertilité et sa texture, peuvent également jouer un rôle important dans la structure des végétations de savanes (Sankaran et al. 2005; Staver et al. 2017). Etant intimement liées, les interactions entre la végétation et les propriétés du sol influencent également la structure et la distribution de la végétation et représentent ainsi un acteur majeur du fonctionnement des écosystèmes (Wardle et al. 2004; Faucon et al. 2017; Srikanthasamy et al. 2018). C’est donc toute une série d’interactions complexes entre le climat, le feu, l’herbivorie, la végétation et le sol qui sont à l’origine de la structure de la végétation de ces écosystèmes.
Le feu a joué un rôle important dans l’évolution des espèces de savanes (Keeley et Rundel 2005; Simon et al. 2009; Lehmann et al. 2014) et ce, avant l’apparition des hommes (du genre Homo) puisque l’émergence des savanes, associée à l’expansion des graminées en C4 remonte au Miocène (Keeley et Rundel 2005; Edwards et al. 2010). On peut aussi noter que les espèces d’arbres présentes dans les savanes ne sont pas les mêmes que celles des forêts (Dantas et al. 2013; Charles-Dominique et al. 2015, 2017). Les espèces de savane présentent des traits en relation avec la résilience au feu, comme une écorce épaisse, alors que celles de forêts ont des écorces bien plus fines, les rendant vulnérables au feu. Dans les régions tropicales, de nombreuses savanes seraient des forêts sans la présence de ces perturbations (Bond et al. 2004), car la quantité de précipitations est suffisante pour permettre l’occurrence de forêts : dans ces régions, forêts et savanes sont considérées alors comme des états alternatifs de biome* (Staver et al. 2011; Dantas et al. 2016).

Fig2. : Le feu stimule la repousse de la végétation, ce qui est propice aux herbivores (Rhinocéros blanc, Afrique du Sud).
(Photo : Soizig le Stradic)
Biodiversité et problèmes de conservation
Les savanes représentent un patrimoine exceptionnel. Ce sont des écosystèmes extrêmement riches en biodiversité et notamment en espèces endémiques. A titre d’exemple, la savane brésilienne appelée Cerrado, qui s’étend sur deux millions de km², est composée de plus de 12 000 espèces végétales (Mendonça et al. 2008) – c’est la savane la plus riche en espèces à l’échelle mondiale. Les savanes africaines, en plus de leur richesse végétale, sont emblématiques pour abriter une faune exubérante comprenant éléphants, zèbres, girafes, lions et léopards : autant d’animaux adaptés à ces écosystèmes ouverts plutôt qu’aux forêts. Les savanes font également partie de notre patrimoine culturel et de notre histoire. Ainsi certaines études ont montré que les humains ont une préférence innée pour les paysages ouverts, qui pourrait provenir de notre longue histoire évolutive dans les savanes d’Afrique de l’est et que ces milieux pourraient être considérés comme moteur de l’évolution humaine (Falk et Balling 2010).
Cependant les activités humaines, si elles n’en sont pas à l’origine, ont, au fil du temps profondément impacté les régimes de feu et l’herbivorie et de fait la distribution des savanes (Archibald et al. 2012). Aujourd’hui encore beaucoup de populations vivent au cœur de ces écosystèmes et dépendent des services qu’ils fournissent, entre autres le contrôle de la qualité de l’eau, la possibilité de pâturage, la présence de gibier.
Malgré le patrimoine culturel et naturel qu’ils représentent, les écosystèmes herbacés tropicaux sont largement menacés par la conversion de grandes surfaces pour l’agriculture, par des politiques de suppression des feux, et par la plantation d’arbres dans un but commercial ou parfois dans un contexte de compensation des émissions carbone. Le Cerrado par exemple enregistre un taux de conversion en terres agricoles bien supérieur aux taux de conversion enregistrés en forêt amazonienne (Overbeck et al. 2007; Beuchle et al. 2015).

Fig.3 : Culture de soja, Cerrado, Brésil (Source : Chain Reaction Research)
La résilience des savanes
Face aux perturbations naturelles comme le feu ou l’herbivorie les savanes sont extrêmement résilientes et le maintien des physionomies ouvertes dépend même de la présence de ces perturbations (Buisson et al. 2019). Si en Afrique, la présence de grands herbivores permet de conserver les milieux ouverts, en parallèle de feux réguliers assurant une régénération du couvert herbacé, dans les autres régions du monde, le feu, seul, est majoritairement responsable du maintien des milieux ouverts.
Bien que les feux dans les savanes soient à l’origine, naturels (éclairs durant les orages) (Bond et Zaloumis 2016), les activités humaines ont depuis longtemps (au moins 300 000 ans) influencé les régimes de feux avec une augmentation des surfaces brulées en parallèle de l’évolution humaine. L’impact substantiel des activités humaines sur les régimes de feux semble cependant être plus récent et pourrait remonter à environ 4000 ans (Archibald et al. 2012). Suite à la mise en place du pastoralisme, la surface de terres brûlées a diminué, en raison de la réduction du biocombustible par le bétail (Marlon et al. 2008; Archibald et al. 2012).
La mise à disposition des nutriments sous forme de cendre, la présence de bourgeons souterrains, la protection des bourgeons sous une écorce épaisse ou encore la présence d’importants organes souterrains pour le stockage des nutriments, permettent à la végétation, que ce soit les espèces ligneuses ou herbacées, de repousser très rapidement après un feu.
En revanche, au cours des dernières décennies, les activités humaines ont largement modifié les régimes de feux, leur fréquence et leur intensité, augmentant globalement les surfaces brûlées, et modifiant la taille des surfaces brûlées bien qu’on observe des différences régionales (Mouillot et Field 2005; Archibald et al. 2013). De nombreux gouvernements (au Brésil, Botswana, Zimbabwe, Afrique du Sud par exemple) ont mis en place des programmes de prévention et d’exclusion des feux selon lesquels tous les feux doivent être systématiquement combattus et éteints lorsque cela est possible.
Cependant ces modifications et perturbations d’origines anthropiques comme l’exclusion des feux (qui se solde par l’accumulation de biocombustibles), le pâturage intensif par les chèvres ou bovins, ou encore l’introduction d’espèces invasives animales ou végétales, peuvent parfois modifier largement la composition des communautés végétales et de fait certains processus écosystémiques (Buisson et al. 2019). La résilience* des écosystèmes dépendra alors de la durée et de l’intensité de telles perturbations. Lorsque les perturbations sont plus intenses ou en cas de modification majeures du milieu comme l’afforestation, la conversion en terres agricoles ou les activités minières, les modifications de la végétation et du sol sont si importantes que la résilience naturelle est réduite voire inexistante (Buisson et al. 2019).

Fig 4 : Expérimentation de feux prescrits dans le Cerrado, Serra do Tombador, Brésil.
a) Végétation avant le feu, b) parcelle récemment brulée et c) quelques temps après le feu.
(Photos : a) et b) Juliana Teixeira, c) Laboratório de Ecologia da Vegetação – LEVeg, Rio Claro).
La dégradation et la conversion des savanes peuvent être très rapides et bien souvent peu réversibles. En effet, bien souvent le seuil de dégradation au-delà duquel le rétablissement spontané des savanes est impossible ou sera très long est rapidement dépassé, car les processus d’assemblage des communautés sont lents et dépendants de nombreuses interactions (avec le sol entre autres), et la dispersion des graines est souvent limitée. Les actions de restauration actives sont dans ces cas-là essentielles.
Restauration des écosystèmes herbacés tropicaux
Ces écosystèmes étant le fruit de plusieurs millions d’années d’évolution et d’interactions écologiques complexes, leur restauration reste aujourd’hui encore, un vrai défi. Une première étape, pour la conservation ou la restauration de ces écosystèmes, est la prise en compte des perturbations naturelles occasionnées par les feux et par les grands herbivores. Ainsi les techniques de restauration des savanes comprennent notamment la réintroduction des perturbations naturelles comme l’utilisation de feux dirigés, la gestion du pâturage, la réintroduction des herbivores, mais aussi l’élimination des espèces invasives.
En cas de dégradations majeures, il faut également pouvoir réintroduire et propager les espèces autochtones, ce qui peut être compliqué pour la plupart des espèces herbacées dont l’écologie et la biologie sont peu documentées. Par exemple certaines espèces produisent peu ou pas de graines, ou n’ont pas un ‘calendrier de reproduction’ régulier, dépendent du feu pour se reproduire sexuellement, ou présentent une dormance qui doit être levée (Dayrell et al. 2017). Bien que la restauration de la strate herbacée soit fondamentale pour restaurer les processus écologiques de ces écosystèmes, elle s’avère jusqu’alors bien souvent, infructueuse, souvent limitée par la colonisation et la compétition avec des espèces invasives, ou par le fait que les graines d’espèces herbacées autochtones ne soient pas disponibles et/ou que leur propagation ne soit pas efficace (Le Stradic et al. 2016; Pilon et al. 2018; Schmidt et al. 2019).

Fig.5 : En cas de dégradations majeures, les écosystèmes herbacés tropicaux ne sont pas résilients et des programmes de restauration sont alors nécessaires. République Démocratique du Congo. (Photo : Soizig Le Stradic).
Afforestation
L’autre problème, pour restaurer les savanes, est qu’elles sont souvent mal considérées, sans doute parce que leur biodiversité et l’importance des services (écosystémiques) qu’elles rendent aux sociétés ne sont pas toujours évidents à percevoir par les personnes non averties, y compris par les entités gouvernementales qui pourraient mettre en place des programmes de conservation.
Souvent à tort, les savanes sont considérées comme des forêts dégradées (Aleman et al. 2018), ce qui complique les perceptions concernant ces écosystèmes et qui justifie les programmes d’exclusion des feux. Ainsi de nombreux projets de « restauration » de savanes consistent à planter des arbres. Cependant la plantation massive d’arbres n’est pas une technique de restauration appropriée et n’est pas recommandée pour les savanes, spécialement parce que les espèces herbacées, notamment les Poacées en C4*, sont généralement inadaptées à l’ombre. Ainsi la régénération spontanée de la strate herbacée sera largement compromise, pour ne pas dire impossible en présence d’un couvert arboré important. En conséquence le retour à des régimes de feux proches des régimes naturels, la présence d’herbivores et les processus qui en découlent, seront également compromis en l’absence de biomasse herbacée (source de nourriture et combustible). Il apparait évident que rétablir la strate herbacée doit être une priorité pour restaurer ces écosystèmes.
Lancé en 2011, le « Défi de Bonn » a pour objectif de restaurer 150 millions d’hectares de terres dégradées et déboisées d’ici à 2020, et 350 millions d’hectares d’ici à 2030. Dans ce contexte, plusieurs initiatives ayant pour objectif de promouvoir et de définir des zones potentielles de restauration de forêts ont émergé. L’idée est de promouvoir le reboisement et la plantation d’arbres à large échelle, en tant que solution au changement climatique ; les arbres absorbant durant leur croissance et conservant une grande partie du CO2 émis par les activités humaines. Plusieurs initiatives ont mis en avant des zones potentielles de restauration de forêts (Laestadius et al. 2011; Bastin et al. 2019) et si l’on peut saluer l’existence de tels projets lorsqu’il s’agit de restaurer des forêts dégradées, il faut avertir du risque d’afforester des zones où l’on avait auparavant des savanes et autres pelouses tropicales.
Plusieurs études ont déjà pointé le risque lié à la plantation d’arbres dans des écosystèmes dits « ouverts » (même si le couvert arboré peut être assez important) où la strate herbacée est primordiale et dominée par des espèces intolérantes à l’ombre, tels que les savanes (Veldman et al. 2015b; Bond 2016; Pausas et Bond 2020). Ici, il faut être clair : planter des arbres dans de tels écosystèmes n’est pas de la restauration, et orienter les politiques publiques dans ce sens est une erreur encore plus grave lorsque les arbres choisis sont d’origine exotique et qu’on ne plante qu’une seule espèce d’arbre sur de grandes surfaces.
En outre, si l’argument majeur pour planter des arbres est qu’il s’agit d’une des meilleures solutions pour lutter contre le réchauffement climatique, il est également important de rappeler que dans les savanes la majorité de la biomasse est souterraine et les stocks de carbone localisés sous terre sont loin d’être négligeables (Jackson et al. 1996; Poorter et al. 2012).
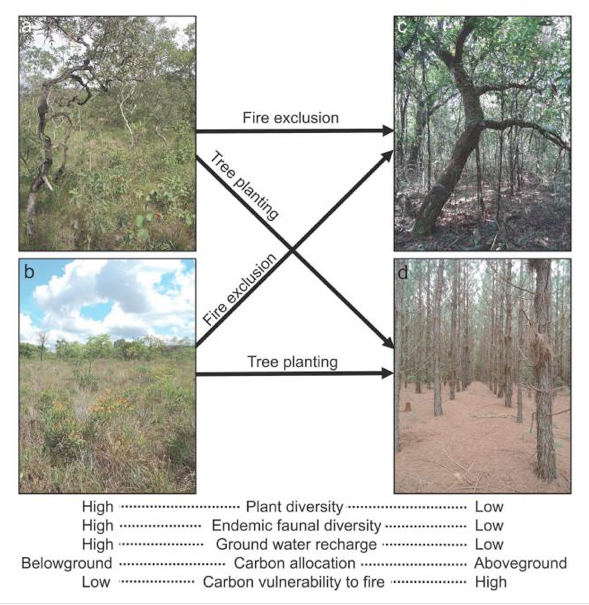
Fig.6 : Exemples de transformation des savannes brésiliennes du Cerrado, que ce soient :
a) des physionomies assez arborées ou b) des physionomies peu arborées, par l’exclusion des feux et la plantation d’arbres. Les écosystèmes sont alors remplacés par c) de la forêt et/ou d) une monoculture (D’après Veldman et al., 2015b).
Outre la perte de la biodiversité animale et végétale liée à l’afforestation de ces écosystèmes ouverts (Abreu et al. 2017), les dommages sont également mesurables au niveau économique, spécialement pour certaines populations dont l’activité repose sur les savanes que ce soit pour le pâturage, l’approvisionnement en gibier ou la sécurité de certains services écosystémiques, notamment l’approvisionnement et la qualité de l’eau (Farley et al. 2005; Honda et Durigan 2016). En plus de la perte de biodiversité, d’habitats pour de nombreuses espèces animales et la dégradation de nombreux services écosystémiques, préconiser la plantation massive d’arbres dans des écosystèmes sujets au feu conduit à augmenter les risques de feux massifs (Balch et al. 2018).
Conclusion
Restaurer les forêts dégradées, notamment en replantant des arbres, est essentiel, mais la plantation d’arbres ne peut compromettre la conservation et la restauration d’autres écosystèmes. La restauration écologique est un outil qui doit permettre de rétablir les écosystèmes dégradés, mais en aucun cas de détruire des écosystèmes naturels. Puisque la restauration des savanes reste difficile, les politiques environnementales devraient donner la priorité à leur conservation. Valoriser la biodiversité et reconnaitre les services écosystémiques que ces écosystèmes fournissent est un premier pas pour améliorer leur conservation, en parallèle de la gestion des zones naturelles, ce qui implique l’utilisation de feux dirigés, la présence de feux naturels et / ou de l’herbivorie par la mégafaune autochtone.
Glossaire
- Afforestation (ou boisement) : création d’une forêt sur des terres qui historiquement n’en portaient pas, ou/et où la végétation ou l’utilisation précédente des terres n’était pas une forêt (Watson et al. 2000)
- Biome : ensemble d’écosystèmes caractéristique d’une aire biogéographique. Il est l’expression des conditions écologiques du lieu (climat, sols, etc.) et est défini par une végétation présentant une forme de vie (arbres, arbustes, plantes herbacées) dominante qui reste stable au fil des générations. Les forêts décidues tropicales, les forêts tempérées décidues, les mangroves, la toundra sont des exemples de biomes.
- Ecosystème primaire ou ancien : écosystème présentant un grand niveau de naturalité, sans perturbation importante (donc peu détruit et peu exploité) depuis longtemps. Le terme est surtout utilisé pour désigner les forêts primaires qui sont des forêts intactes que l’on retrouve surtout en zone tropicale comme la forêt amazonienne ou la forêt du bassin du Congo. Mais le terme peut aussi s’appliquer à des écosystèmes herbacés comme les savanes. On traduit écosystème primaire en anglais par « Old-growth ecosystems ». Dans la définition anglaise on retrouve la notion d’ancienneté qui est fondamentale dans la définition de ces écosystèmes.
- Etats Alternatifs de Biome: deux ou plusieurs types de biomes peuvent apparaitre sous les mêmes conditions environnementales (sous les mêmes conditions climatiques notamment), s’ils diffèrent dans leur régime de perturbation.
- Forb ou phorbe: plantes herbacées à fleurs ne présentant pas de tissu ligneux, ce qui les distingue des arbustes et sous arbustes. Le terme de forb est opposé au terme graminoïdes qui regroupe les plantes herbacées sans tissu ligneux présentant un port proche de celui des graminées (par exemple les graminées elles mêmes, les joncs ou les carex).
- Graminées en C4* : type de photosynthèse débutant par la formation d’une molécule comportant quatre atomes de carbone (C4). Ce type est adapté aux milieux chauds ou arides car il permet de limiter les pertes en eau. Très commun chez les graminées tropicales ou d’origine tropicale, telles que millet et le maïs.
- Photosynthèse (types) : La photosynthèse est le processus qui permet de synthétiser de la matière organique à partir de composés minéraux (dioxyde de carbone et eau), en utilisant l’énergie lumineuse du soleil. Il existe trois types de photosynthèse chez les êtres vivants, en fonction de la manière de fixer le carbone : la fixation en C3, la plus commune, en C4* et CAM que l’on trouve chez les plantes poussant en environnement aride.
- Perturbation: évènement ponctuel (souvent peu fréquent) qui modifie l’état d’un écosystème.
- Résilience d’un écosystème: capacité d’un écosystème à se régénérer et à revenir à l’état de référence suite à une perturbation (c’est-à-dire à l’état avant perturbation).
- Résistante d’un écosystème: Capacité d’un écosystème à persister ou à maintenir sa fonction face aux perturbations exogènes.
- Restauration écologique: Action intentionnelle qui initie, assiste ou accélère la récupération d’un écosystème qui a été dégradé, endommagé ou détruit (SER 2004).
Remerciements
Merci à Anne Teyssèdre et Sébastien Barot pour leurs relectures, remarques et suggestions.

Savane, Zimbabwe (photo Sébastien Barot)
Bibliographie
Abreu R.C.R., Hoffmann W.A., et al., 2017. The biodiversity cost of carbon sequestration in tropical savanna. Sci. Adv., 3, e1701284.
Aleman J.C., Jarzyna M.A. & Staver A.C., 2018. Forest extent and deforestation in tropical Africa since 1900. Nat. Ecol. Evol., 2, 26–33.
Archibald S., Lehmann C.E.R., Gomez-Dans J.L. & Bradstock R.A., 2013. Defining pyromes and global syndromes of fire regimes. Proc. Natl. Acad. Sci., 110, 6442–6447.
Archibald S., Staver A.C. & Levin S.A., 2012. Evolution of human-driven fire regimes in Africa. Proc. Natl. Acad. Sci., 109, 847–852.
Balch J., Schoennagel T., et al., 2018. Switching on the Big Burn of 2017. Fire, 1, 17.
Bastin J.-F., Finegold Y., et al., 2019. The global tree restoration potential. Science (80-. )., 365, 76–79.
Beuchle R., Grecchi R.C., et al., 2015. Land cover changes in the Brazilian Cerrado and Caatinga biomes from 1990 to 2010 based on a systematic remote sensing sampling approach. Appl. Geogr., 58, 116–127.
Bond W. & Zaloumis N.P., 2016. The deforestation story: testing for anthropogenic origins of Africa’s flammable grassy biomes. Philos. Trans. R. Soc. B Biol. Sci., 371, 20150170.
Bond W.J. 2016. Ancient grasslands at risk. Science, 351, 120–122.
Bond W.J., Woodward F.I. & Midgley G.F., 2004. The global distribution of ecosystems in a world without fire. New Phytol., 165, 525–538.
Buisson E., Le Stradic S. et al., 2019. Resilience and restoration of tropical and subtropical grasslands, savannas, and grassy woodlands. Biol. Rev., 94, 590-609
Charles-Dominique T., Beckett H., Midgley G.F. & Bond W.J. 2015. Bud protection: a key trait for species sorting in a forest-savanna mosaic. New Phytol.
Charles-Dominique T., Midgley G.F. & Bond W.J. 2017. Fire frequency filters species by bark traits in a savanna-forest mosaic. J. Veg. Sci., 28, 728–735.
Dantas V. de L., Batalha M.A. & Pausas J.G., 2013. Fire drives functional thresholds on the savanna–forest transition. Ecology, 94, 2454–2463.
Dantas V. de L., Hirota M., Oliveira R.S. & Pausas J.G., 2016. Disturbance maintains alternative biome states. Ecol. Lett., 19, 12–19.
Dayrell R.L.C., Garcia Q.S., et al., 2017. Phylogeny strongly drives seed dormancy and quality in a climatically buffered hotspot for plant endemism. Ann. Bot., 119, 267–277.
Edwards E.J., Osborne C.P., et al., (2010). The Origins of C4 Grasslands: Integrating Evolutionary and Ecosystem Science. Science (80-. )., 328, 587–591.
Falk J.H. & Balling J.D., 2010. Evolutionary Influence on Human Landscape Preference. Environ. Behav., 42, 479–493.
Farley K.A., Jobbagy E.G. & Jackson R.B., 2005. Effects of afforestation on water yield: a global synthesis with implications for policy. Glob. Chang. Biol., 11, 1565–1576.
Faucon M.-P., Houben D. & Lambers H., 2017. Plant Functional Traits: Soil and Ecosystem Services. Trends Plant Sci., xx, 1–10.
February E.C. & Higgins S.I., 2010. The distribution of tree and grass roots in savannas in relation to soil nitrogen and water. South African J. Bot., 76, 517–523.
Hoffmann W.A., 1998. Fire and population dynamics of woody plants in a neotropical savanna: matrix model projections. Ecology, 80, 1354–1369.
Honda E.A. & Durigan G., 2016. Woody encroachment and its consequences on hydrological processes in the savannah. Philos. Trans. R. Soc. B Biol. Sci., 371, 20150313.
Jackson R.B., Canadell J., et al., 1996. A global analysis of root distributions for terrestrial biomes. Oecologia, 108, 389–411.
Keeley J.E. & Rundel P.W. 2005. Fire and the Miocene expansion of C4 grasslands. Ecol. Lett., 8, 683–690.
Laestadius L., Maginnis S., et al., 2011. Mapping opportunities for forest landscape restoration. Unasylva, 238, 47–48.
Lehmann C.E.R., Anderson T.M., et al., 2014. Savanna vegetation-fire-climate relationships differ among continents. Science 80-. ., 343, 548–552.
Marlon J.R., Bartlein P.J, et al., 2008. Climate and human influences on global biomass burning over the past two millennia. Nat. Geosci., 1, 697–702.
Mendonça R.C., Felfili J.M., et al., 2008. Flora vascular do Bioma Cerrado: checklist com 12.356 espécies. In: Cerrado: ecologia e flora eds. Sano, S. et Almeida, S.. Brasilia, pp. 423–1279.
Mouillot F. & Field C.B., 2005. Fire history and the global carbon budget: a 1ox 1o fire history reconstruction for the 20th century. Glob. Chang. Biol., 11, 398–420.
Overbeck G.E., Müller S.C., et al., 2007. Brazil ’ s neglected biome : The South Brazilian Campos. Perspect. Plant Ecol. Evol. Syst., 9, 101–116.
Parr C.L., Lehmann C.E.R., et al., 2014. Tropical grassy biomes: misunderstood, neglected, and under threat. Trends Ecol. Evol., 29, 205–213.
Pausas J.G. & Bond W.J. 2020. Alternative Biome States in Terrestrial Ecosystems. Trends Plant Sci., 1–14.
Pilon N.A.L., Buisson E. & Durigan G., 2018. Restoring Brazilian savanna ground layer vegetation by topsoil and hay transfer. Restor. Ecol., 26, 73–81.
Poorter H., Niklas K.J., et al., 2012. Biomass allocation to leaves, stems and roots: meta-analyses of interspecific variation and environmental control. New Phytol., 193, 30–50.
Rossatto D.R., Silva L.C.R., Sternberg L.S.L. & Franco A.C., 2014. Do woody and herbaceous species compete for soil water across topographic gradients? Evidence for niche partitioning in a Neotropical savanna. South African J. Bot., 91, 14–18.
Sankaran M., Hanan N.P., et al., 2005. Determinants of woody cover in African savannas. Nature, 438, 846–849.
Schmidt I.B., Ferreira M.C., et al., 2019. Tailoring restoration interventions to the grassland‐savanna‐forest complex in central Brazil. Restor. Ecol., 27, 942–948.
Scholes R.J. & Archer S.R., 1997. Tree-grass interactions in savannas. Annu. Rev. Ecol. Syst., 28, 517–544.
SER, 2004. The SER International Primer on Ecological Restoration. www.ser.org.
Silva I.A. & Batalha M.A. 2011. Plant functional types in Brazilian savannas: The niche partitioning between herbaceous and woody species. Perspect. Plant Ecol. Evol. Syst., 13, 201–206.
Simon M.F., Grether R., et al., 2009. Recent assembly of the Cerrado, a neotropical plant diversity hotspot, by in situ evolution of adaptations to fire. Proc. Natl. Acad. Sci. U. S. A., 106, 20359–20364.
Srikanthasamy T., Leloup J., et al., 2018. Contrasting effects of grasses and trees on microbial N-cycling in an African humid savanna. Soil Biol. Biochem., 117, 153–163.
Staver A.C., Archibald S. & Levin S.A. 2011. The global extent and determinants of savanna and forest as alternative biome states. Science, 334, 230–232.
Staver A.C., Botha J. & Hedin L. 2017. Soils and fire jointly determine vegetation structure in an African savanna. New Phytol., 216, 1151–1160.
Le Stradic S., Séleck M., et al., 2016. Comparison of translocation methods to conserve metallophyte communities in the Southeastern D.R. Congo, 23, 13681–13692.
Veldman J.W., Buisson E., et al., 2015a. Toward an old-growth concept for grasslands, savannas, and woodlands. Front. Ecol. Environ., 13, 154–162.
Veldman J.W., Overbeck G.E., et al., 2015b. Where tree planting and forest expansion are bad for biodiversity and ecosystem services. Bioscience, 65, 1011–1018.
Wardle D.A., Bardgett R.D., et al., 2004. Ecological Linkages Between Aboveground and Belowground Biota. Science 80-. ., 304, 1629–1633.
Watson R.T., Noble I.R., et al., 2000. Land use, land-use change and forestry: a special report of the Intergovernmental Panel on Climate Change. Cambridge. Cambridge, UK.
—-
Pour en savoir plus :
Quelques liens :
- Le Challenge de Bonn
https://www.bonnchallenge.org/content/challenge
- Les dangers de l’afforestation des savanes :
https://www.iucn.org/content/restoring-world%E2%80%99s-ecosystems-more-planting-trees
https://theconversation.com/when-tree-planting-actually-damages-ecosystems-120786
https://theconversation.com/face-au-rechauffement-climatique-la-reforestation-nest-quune-partie-de-la-solution-121060
(ou en version originale: https://theconversation.com/exaggerating-how-much-co-can-be-absorbed-by-tree-planting-risks-deterring-crucial-climate-action-120170)
https://ensia.com/voices/tree-planting-afforestation-carbon-sequestration/
https://phys.org/news/2019-10-reforesting-good-idea.html
- La gestion des savanes en utilisant les feux prescrits
https://www.youtube.com/watch?v=izjtPs4a574
https://www.youtube.com/watch?v=A7b1bg6RrK8
https://www.youtube.com/watch?v=XhiLs9FJcpQ
https://www.youtube.com/watch?v=RM72NtXxyLs
https://www.youtube.com/watch?v=qYlF4SHXsAg
—
Regards connexes :
Kéfi S, 2012. Ecosystèmes et transitions catastropiques. Regards et débats sur la biodiversité, SFE2, Regard R37, 19 octobre 2012.
Regards sur la gestion et la gouvernance : https://sfecologie.org/tag/gestion-et-gouvernance/
Sur les habitats : https://sfecologie.org/tag/habitats/
Sur les méthodes et outils : https://sfecologie.org/tag/methodes-et-outils/
Sur la préservation de la biodiversité : https://sfecologie.org/tag/preservation-biodiversite/
Sur les services écosystémiques : https://sfecologie.org/tag/services-ecosystemiques/
Sur les stratégies et politiques : https://sfecologie.org/tag/strategies-et-politiques/
Article édité par Anne Teyssèdre et Sébastien Barot, mis en ligne par AT.
——


Excellent papier, et indispensable contribution au débat sur la « restauration des terrains dégradés », qui se confond de plus en plus avec l’emballement des entreprises pour la « compensation carbone », et qui va se traduire inévitablement par des pertes irréversibles de biodiversité.
Je suggérerais aux auteures de préparer une version un peu plus grand public et de la proposer à The Conversation, ou directement au Monde.
Merci beaucoup pour l’intérêt porté à notre contribution.
Bravo pour l’effort fourni. En République Centrafricaine, on a une zone de savane ( arborée,herborée) dans le Nord Est du pays.Malheureusement, faute de connaissance l’on pense toujours que la conservation par le planting d’arbre d’espèce exotique reste la meilleure méthode, faute de connaissance nous perdons de plus en plus des espèces dans nos savanes. Aussi, beaucoup de partenaires ne financent que les activités de conservation dans la zone forestière ( RCA fait partie du bassin du Congo) et malheureusement, le paturage intensif, les feux de brousse pour la chasse des rats palmistes détruisent les biodiversité de la savane. Alors, comment alors faire pour valoriser la biodiversité de la savane?Merci. Tous nos encouragements.
Super intéressant comme sujet. Je suis lycéen et c’est vrai que dans les média que je suis, le sujet de la dégradation des écosystèmes est souvent abordée. Mais les solutions présentées sont toujours les mêmes : planter des arbres. Donc lire un article qui montre que ce n’est pas toujours le cas c’est super instructif !